博文
化学反应热力学性质的新解析
|
本文拟结合准静态过程假说,解析恒温恒压条件下进行的化学反应热力学性质,供参考.
准静态过程假说
准静态过程假说是(笔者)在平衡态热力学基础上提出的一个新的热力学假说[1-3];对于恒温恒压条件下进
行的化学反应,该假说认为:
δQp=TdS (1)
δWV=-pdV (2)
δW'=dG (3)
dU=δQp+δWV+δW'
=TdS -pdV +dG (4)
式(1)、(2)、(3)及(4)中“Q、WV、W'、U”分别代表化学反应的热量、体势变、有效功及热力
学能.
式(4)显示:化学反应的热力学能变由热量、体势变及有效功三部分构成.
2. 化学反应计算实例
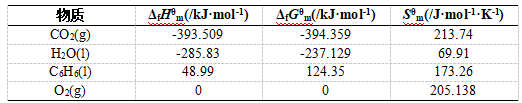
[例1]. 25℃,标态下液态苯(C6H6)完全燃烧反应为:
C6H6(l)+7.5O2(g)=6CO2(g)+3H2O(l)
试计算该燃烧反应的热量、体势变、有效功及热力学能变;25℃,标态下相关物质的热力学性质[4]参见如下
表1所示:
表1. 25℃,标态下相关物质的热力学性质
解:依热力学基本原理可得:
ΔrHθm(298.15K) =6ΔfHθm(CO2,g,298.15K)+3ΔfHθm(H2O,l,298.15K)-
ΔfHθm(C6H6,l,298.15K)-7.5ΔfHθm(O2,g,298.15K)
=6×(-393.509kJ·mol-1)+3×(-285.83kJ·mol-1)-48.99kJ·mol-1-0
=-3267.534kJ·mol-1 (5)
ΔrGθm(298.15K) =6ΔfGθm(CO2,g,298.15K)+3ΔfGθm(H2O,l,298.15K)-
ΔfGθm(C6H6,l,298.15K)-7.5ΔfGθm(O2,g,298.15K)
=6×(-394.359kJ·mol-1)+3×(-237.129kJ·mol-1)-124.35kJ·mol-1-0
=-3202.791kJ·mol-1 (6)
ΔrSθm(298.15K) =6Sθm(CO2,g,298.15K)+3Sθm(H2O,l,298.15K)-
Sθm(C6H6,l,298.15K)-7.5Sθm(O2,g,298.15K)
=6×213.74J·mol-1·K-1+3×69.91J·mol-1·K-1-173.26J·mol-1·K-1-7.5×205.138J·mol-1·K-1
=-219.625J·mol-1·K-1 (7)
则液态苯(C6H6)完全燃烧反应:
Qp=T·ΔrSθm(298.15K) =298.15K×(-219.625J·mol-1·K-1)=-65.481kJ·mol-1 (8)
![]()
=-(6-7.5)×8.314J·mol-1·K-1×298.15K=3.718kJ·mol-1 (9)
W'= ΔrGθm(298.15K) =-3202.791kJ·mol-1 (10)
ΔU=Qp+WV+W'=-65.481kJ·mol-1+3.718kJ·mol-1 -3202.791kJ·mol-1
=-3264.554kJ·mol-1 (11)
依热力学基本原理可得:
ΔH=Qp+W'=T·ΔrSθm(298.15K)+ΔrGθm(298.15K)
=-65.481kJ·mol-1-3202.791kJ·mol-1=-3268.272kJ·mol-1 (12)
对比式(5)及(12)可知,在计算误差允许范围内,两者结果相同,表明该假说体系自洽.
另对于恒温恒压下的化学反应,结合式(11)及(12)可得:
![]() (13)
(13)
3. 结论
对于恒温恒压条件下进行的化学反应,
⑴ Qp=T·ΔrSθm;
⑵ W'= ΔrGθm;
⑶![]() ;
;
⑷ ![]()
参考文献
[1]余高奇. 热力学第一定律研究. 科学网博客, 2021,8.
[2]余高奇. 热力学第二定律研究. 科学网博客, 2021,8.
[3]余高奇. 热力学过程的基本概述. 科学网博客,2023,1.
[4]浙江大学普通化学教研组编, 普通化学(第七版), 北京:高等教育出版社,2020,2:360-364.
https://blog.sciencenet.cn/blog-3474471-1431516.html
上一篇:理想液态混合物中B组分与纯B物质的主要热力学性质比较
下一篇:焓变(dH)的热力学解析