博文
代谢学人--Science&Nature近期代谢精选
||
撰文 | 徐鑫铭 徐梓禾 于柳 许赛男 邱瑾
编辑 | 孟美瑶
校对 | 陈俊桐

运动后难免有伤害

哎呀,八块腹肌拉伤了

仰卧起坐失败
一般躺一晚上
小伤小痛就恢复的差不多了

你是否好奇肌肉组织中发生了什么神奇的事
让胳膊腿儿完好如初了呢?
近期Science给出了新的解答
发现了不依赖于肌肉干细胞(卫星细胞)增殖的
全新损伤修复机制
原来是肌肉细胞的细胞核为了损伤修复操碎了心
人生处处是难关

过了难关,就是海阔天空
对谷胱甘肽(GSH)来说也是这样
GSH对于线粒体中的氧还平衡至关重要
可是它却偏偏在胞浆中合成
那么多GSH为了过线粒体膜这一关
想破了脑袋
近期Nature发现
线粒体膜转运体SLC25A39是
GSH向线粒体内运输的关键因子
都说产热脂肪产热脂肪
你们这么多脂肪
肯定很会产热吧?


然而产热并不是光有脂就可以的!
近期Nature发现
肾上腺素通路激活的米色脂肪产热过程中
糖原代谢扮演着重要作用
糖原的缺乏会造成产热降低
看来米色脂肪也得“吃点糖”才行!
Science
1、生理损伤后的肌肉修复通过细胞核迁移来重塑细胞
原来细胞核还能爬!
中文摘要
骨骼肌的再生是一个高度同步化的过程,需要肌肉干细胞(卫星细胞)参与其中。本文中作者发现,在小鼠和人类中,由运动造成的局部损伤能够激活一种独立于卫星细胞的肌纤维自我修复机制。小鼠肌肉损伤触发了一个涉及钙、Cdc42和磷酸激酶C的信号级联反应,进而能够通过微管和动力蛋白将肌细胞核牵引到受损部位。这些肌细胞核的迁移能够加速肌节修复,并通过局部递送mRNA来重塑细胞。肌纤维自我修复是一种细胞自主的保护机制,本文提出的肌肉修复机制能够为健康或疾病状态下的肌肉结构恢复提供一种全新的理解。
拓展阅读
细胞核迁移及其调控
细胞核迁移是一种细胞核向细胞中特定位点移动的非随机现象,对于生长、分裂以及发育等正常细胞生命活动至关重要。大量研究表明, 这一过程涉及细胞骨架、分子马达和其他相关蛋白的协调作用。在细胞核迁移的过程中,微管组织中心(MTOC)在细胞核和前缘之间重新定向,有助于定向迁移,并受到Cdc42、MRCK、肌球蛋白和肌动蛋白通路的调控。此外,核运动不受到动力蛋白、Par6或PKCzeta的抑制的影响(这些组件对于MTOC重新定位至关重要)。
Cdc42在细胞迁移过程中涉及到多种调控形式。Cdc42可被鸟嘌呤核苷酸交换因子(GEF)激活,从而处于“开启”状态;相反,激活的Cdc42可在GTP酶激活蛋白(GAP)的作用下失活,从而处于“关闭”状态。通常Cdc42只在位于细胞运动前缘的区域被激活。这种区域性的激活引起了微管和微丝等细胞骨架的极性分布,从而规定了细胞爬行的方向。在迁移的过程中,细胞还会经常改变方向。因此,只有严格而且动态地控制处于活性状态的Cdc42的含量和分布,才能实现细胞正常的迁移。
不同于体内的大部分细胞,肌肉细胞是多核细胞。在肌肉细胞中,细胞核只控制一定范围的肌维区域。本文通过抑制或激活Cdc42,确定肌肉细胞的自我修复机制是也是由Cdc42影响微丝微管等细胞骨架的动态,然后调控肌细胞核在细胞质中的迁移。
参考文献:
[1] A F Palazzo, H L Joseph, Y J Chen, D L Dujardin, A S Alberts, K K Pfister, R B Vallee, G G Gundersen.Curr Biol. 2001 Oct 2;11(19):1536-41.
[2] Edgar R Gomes, Shantanu Jani, Gregg G Gundersen. Cell. 2005 May 6;121(3):451-63.
[3] Yidong Shen, Xueliang Zhu.Developmental Cell. 2008 March 11, Vol 14, 342-353
Muscle repair after physiological damage relies on nuclear migration for cellular reconstruction
一作:William Roman,PI:Pura Muñoz-Cánoves
发表单位:Department of Experimental & Health Sciences, University Pompeu Fabra
Abstract
Regeneration of skeletal muscle is a highly synchronized process that requires muscle stem cells (satellite cells). We found that localized injuries, as experienced through exercise, activate a myofiber self-repair mechanism that is independent of satellite cells in mice and humans. Mouse muscle injury triggers a signaling cascade involving calcium, Cdc42, and phosphokinase C that attracts myonuclei to the damaged site via microtubules and dynein. These nuclear movements accelerate sarcomere repair and locally deliver messenger RNA (mRNA) for cellular reconstruction. Myofiber self-repair is a cell-autonomous protective mechanism and represents an alternative model for understanding the restoration of muscle architecture in health and disease.
原文链接:https://www.science.org/doi/10.1126/science.abe5620
Nature
2、SLC25A39是哺乳动物细胞中谷胱甘肽进入线粒体过程所必需的载体
谷胱甘肽哪里来?线粒体SLC25A39领进门!
中文摘要
谷胱甘肽(GSH)是一种广泛存在于所有真核生物中的小分子硫醇,在氧化代谢中起关键作用。线粒体作为氧化反应的主要场所,必须保持足够的GSH水平来进行自我保护和生物合成。GSH只能在细胞质中合成,而GSH进入线粒体的具体分子机制尚不清楚。利用细胞器蛋白质组学和代谢组学方法,作者发现SLC25A39(线粒体膜上的载体蛋白,功能未知)可以调控GSH向线粒体内转运。SLC25A39缺失会显著减少线粒体中GSH的转运和含量,但不影响胞内GSH水平;同时缺失SLC25A39及其同源物SLC25A40会导致含有铁硫簇的蛋白活性和稳定性下降。此外,作者发现线粒体GSH转运对于体外细胞增殖和小鼠红细胞发育是必须的。当在线粒体中异源表达工程改造的双功能细菌GSH生物合成酶(GshF)时,可以在线粒体中大量合成GSH并改善因GSH耗尽引起的代谢和增殖缺陷。最后,线粒体中的GSH含量可负反馈调节SLC25A39蛋白丰度,从而在哺乳动物细胞中偶联氧化还原平衡与线粒体GSH转运。因此,本文揭示了SLC25A39是线粒体GSH转运机制中所必需且可调控的载体。
拓展阅读
GSH的生物合成及代谢调控
GSH作为机体氧化还原反应过程中重要的生物活性分子,可由γ-谷氨酰半胱氨酸合成酶和谷胱甘肽合成酶催化合成。具体的机制为:L-谷氨酸,L-半胱氨酸在γ-谷氨酰半胱氨酸合成酶(GSH I)的作用下合成γ-谷氨酸半胱氨酸(γ-ECG),进而在谷胱甘肽合成酶(GSHⅡ)的作用下与甘氨酸发生反应,最终形成GSH。
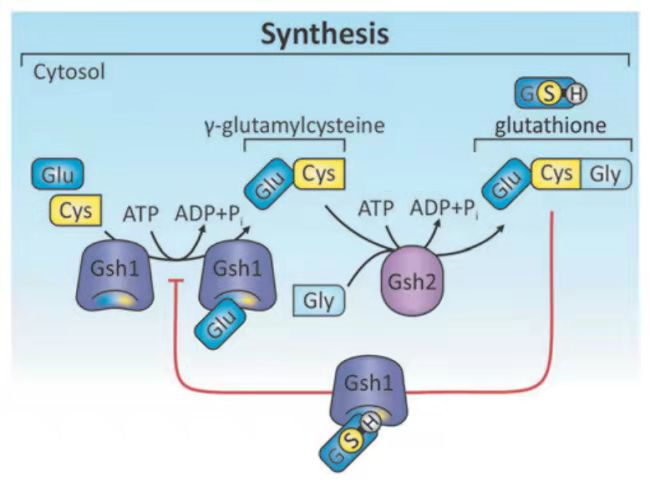
GSH合成流程图
影响生物体内GSH合成的重要因素包括GSHⅠ与GSHⅡ的活性以及ATP的供给。GSH在体内的生物合成通常在GSHⅠ的作用下进行,并且GSHⅠ受到谷胱甘肽产物的反馈抑制,除此之外还受两个转录因子Yap 1P和Skn7P控制。
本文中发现SLC25A39能够介导线粒体GSH的转运,GSH也能负反馈调节SLC25A39的合成,因此细胞才能维持正常的氧化平衡状态。
参考文献:
[1] Bansal, A., & Simon, M. C. (2018). The Journal of Cell Biology, 217(7), 2291–2298.
[2] Calabrese, G., Morgan, B., & Riemer, J. (2017).Antioxidants & Redox Signaling, 27(15), 1162–1177.
SLC25A39 is necessary for mitochondrial glutathione import in mammalian cells
一作:Ying Wang,PI:Kıvanç Birsoy
发表单位:Laboratory of Metabolic Regulation and Genetics, The Rockefeller University
Abstract
(GSH) is a small-molecule thiol that is abundant in all eukaryotes and has key roles in oxidative metabolism1. Mitochondria, as the major site of oxidative reactions, must maintain sufficient levels of GSH to perform protective and biosynthetic functions2. GSH is synthesized exclusively in the cytosol, yet the molecular machinery involved in mitochondrial GSH import remains unknown. Here, using organellar proteomics and metabolomics approaches, we identify SLC25A39, a mitochondrial membrane carrier of unknown function, as a regulator of GSH transport into mitochondria. Loss of SLC25A39 reduces mitochondrial GSH import and abundance without affecting cellular GSH levels. Cells lacking both SL25A39 and its paralogue SLC25A40 exhibit defects in the activity and stability of proteins containing iron–sulfur clusters. We find that mitochondrial GSH import is necessary for cell proliferation in vitro and red blood cell development in mice. Heterologous expression of an engineered bifunctional bacterial GSH biosynthetic enzyme (GshF) in mitochondria enables mitochondrial GSH production and ameliorates the metabolic and proliferative defects caused by its depletion. Finally, GSH availability negatively regulates SLC25A39 protein abundance, coupling redox homeostasis to mitochondrial GSH import in mammalian cells. Our work identifies SLC25A39 as an essential and regulated component of the mitochondrial GSH-import machinery.
原文链接:https://www.nature.com/articles/s41586-021-04025-w
3、糖原代谢将脂肪细胞中的葡萄糖稳态与产热联系起来
糖代谢与脂肪组织产热的新联系
中文摘要
脂肪细胞通过持续表达 UCP1 (解偶联蛋白1)来增加能量消耗,以应对长时间的交感神经激活。作者研究发现,儿茶酚胺对糖原代谢的调节对UCP1的表达至关重要。长期的β-肾上腺素能激活会在表达UCP1的脂肪细胞中增加糖原积累。脂肪细胞特异性的敲除一个支架蛋白—PTG (靶向糖原蛋白)可以降低米色脂肪细胞中的糖原水平,并降低UCP1表达和肥胖小鼠被寒冷或β-肾上腺素能受体激活所诱导的体重减轻。令人意外的是,研究人员观察到,糖原的合成和降解在儿茶酚胺的刺激下会增加,而且糖原的转换为活性氧产生并激活p38 MAPK途径、进而驱动UCP1表达所必须。因此,糖原在脂肪细胞中起着关键的调节作用,本项研究将糖代谢与产热联系起来。
拓展阅读
糖原的调节代谢
糖原(C₂₄H₄₂O₂₁)是一种动物淀粉,是由葡萄糖结合而成的支链多糖,是动物的贮备多糖。哺乳动物体内,糖原主要存在于骨骼肌(约占整个身体的糖原的2/3)和肝脏(约占1/3)中,其他大部分组织中,如心肌、肾脏、脑等,也含有少量糖原。低等动物和某些微生物(如真菌)中,也含有糖原或糖原类似物。
糖原合成是在糖原合酶的催化下经活化形式的葡萄糖与引物分子(未降解完全的糖原分子或糖原素)合成糖原。糖原分解是指糖原在无机磷酸存在下,经磷酸化酶催化,从糖原分子非还原端α-1,4糖苷键开始逐步地磷酸解,释放出葡萄糖-1-磷酸,直至生成极限糊精。葡萄糖-1-磷酸经葡萄糖磷酸变位酶催化生成葡萄糖-6-磷酸。最后在肝脏的葡萄糖-6-磷酸酶催化下,水解成葡萄糖。
体内肾上腺素和胰高血糖素可通过cAMP连锁酶促反应逐级放大,构成一个调节糖原合成与分解的控制系统。当机体受到某些因素影响,如血糖浓度下降和剧烈活动时,可促进肾上腺素和胰高血糖素分泌增加,这两种激素与肝或肌肉等组织细胞膜受体结合,通过一系列级联反应,使糖原合成酶失活,而糖原磷酸化酶活化,最终抑制糖原生成,促进糖原分解,肝糖原分解为葡萄糖释放入血,使血糖浓度升高,而肌糖原分解用于肌肉收缩。
参考文献:
[1] Roach PJ, et al. Bio chem J. 2012 Feb 1;441(3):763-87.
Glycogen metabolism links glucose homeostasis to thermogenesis in adipocytes
一作:Omer Keinan,PI:Alan R Saltiel
发表单位:Department of Medicine, University of California San Diego
Abstract
Adipocytes increase energy expenditure in response to prolonged sympathetic activation via persistent expression of uncoupling protein 1 (UCP1). Here we report that the regulation of glycogen metabolism by catecholamines is critical for UCP1 expression. Chronic β-adrenergic activation leads to increased glycogen accumulation in adipocytes expressing UCP1. Adipocyte-specific deletion of a scaffolding protein, protein targeting to glycogen (PTG), reduces glycogen levels in beige adipocytes, attenuating UCP1 expression and responsiveness to cold or β-adrenergic receptor-stimulated weight loss in obese mice. Unexpectedly, we observed that glycogen synthesis and degradation are increased in response to catecholamines, and that glycogen turnover is required to produce reactive oxygen species leading to the activation of p38 MAPK, which drives UCP1 expression. Thus, glycogen has a key regulatory role in adipocytes, linking glucose metabolism to thermogenesis.
原文链接:https://www.nature.com/articles/s41586-021-04019-8
关注微信公众号代谢学人
了解更多前沿资讯

https://blog.sciencenet.cn/blog-3483272-1313614.html
上一篇:代谢学人--小鼠原代肝细胞提取之实操篇
下一篇:代谢学人--Cell Metabolism: WATCH OUT!可变剪切剪出脂肪性肝炎 2021-11-28