博文
代谢学人--代谢典藏 | Cell metabolism 综述:肝因子在NAFLD中的作用
||
代谢典藏 | Cell metabolism 综述:肝因子在NAFLD中的作用

撰文 | 申芸佳 朱丽君 刘爽 曹玉香 李国强
编辑 | 孟美瑶
校对 | 刘爽

▼ 重点(Highlights)
1.NAFLD的病理生理学受到脂肪组织、骨骼肌以及肠道影响。
2.NAFLD与肥胖、2型糖尿病和心脏代谢疾病风险因果关系。
3.NAFLD中肝因子的表达和分泌失调。
摘要
非酒精性脂肪性肝病(NAFLD)不仅是胰岛素抵抗的结果,也是引起胰岛素抵抗和许多非传染性疾病(NCDs)的重要诱因。脂肪肝与内脏型肥胖关系密切,因此掩盖了脂肪肝对胰岛素抵抗和NCD发病机制的重要贡献。为了克服这一限制,研究人员在2008年引入了术语“肝因子”(与脂肪因子的概念类似)来描述胎球蛋白A在能量代谢中的作用。之后,研究人员又陆续对其他几种肝因子与能量代谢之间的关系进行了探索。在本综述中,研究人员讨论了NAFLD患者肝因子失调及肝因子介导的器官间对话介导的NAFLD相关心血管代谢疾病的病理生理机制。最后,研究人员指出对特定肝因子和脂肪因子的检测可以有助于对NAFLD和内脏型肥胖患者的胰岛素抵抗进行病理机制分类,以便在临床实践中更好地实施精准医疗。
非酒精性脂肪性肝病(NAFLD)的病理分型涵盖非酒精性脂肪肝(NAFL)和非酒精性脂肪性肝炎(NASH),是慢性肝病和肝细胞癌的主要病因。此外,大数据分析结果显示,NAFLD与糖尿病、心血管疾病、新发心力衰竭和肝外癌症风险增加息息相关。
NAFLD与心血管代谢疾病有着相对较强的流行病学关系,表明NAFLD与肥胖相关的心血管代谢疾病之间存在非常密切的病理生理关系。在全球范围内,普通成年人群中NAFLD患病率约为25%,超重和肥胖人群中NAFLD患病率约为40%-60%,糖尿病患者人群中NAFLD患病率最高,约为55%-70%。因此,NAFLD已经像肥胖、糖尿病、心血管疾病以及肥胖和糖尿病相关癌症这些非传染性疾病一样,成为了一种流行性疾病。NAFLD是代谢性疾病导致的结果还是引起代谢性疾病的诱因是个非常重要的问题。无论因果,其背后的病理生理学联系都具有很高的临床相关性。代谢疾病如何促进肝脏脂肪变性和NAFLD发展为严重的肝脏疾病(如晚期纤维化和肝硬化),确定其中最关键的机制将为降低肝脏相关疾病发病率和死亡率提供新的策略。另一方面,NAFLD患者因心血管代谢疾病死亡的概率是因肝脏相关疾病死亡的两倍。因此,确定NAFLD疾病相关的心血管代谢紊乱病理生理机制,可以为降低危及生命的心血管疾病的风险提供新的思路。
本综述讨论了NAFLD患者肝因子的失调,并通过关注与肝因子失调相关的2型糖尿病和心血管疾病的病理机制,提出通过特定的肝因子和脂肪因子表达来确定NAFLD患者亚型,为临床实践中更好地进行精准医疗。
NAFLD作为代谢疾病的结果
葡萄糖、果糖和饱和脂肪酸的过量摄入会诱导肝脏中脂质从头合成,脂肪组织和肝脏的亚临床炎症(小编注:亚临床炎症是组织器官应对损害性应激或异常生理过程表现出介于炎症和正常之间的状态,其目的是维持正常功能和代谢稳态),以及脂肪组织、肝脏和骨骼肌的胰岛素抵抗。这种生活方式也引起2型糖尿病患病风险增加,其中胰岛素抵抗引起的高胰岛素血症可以促进肝脏从头脂肪生成,而进行性的β细胞功能障碍又会加重高血糖。此外,来自脂肪组织的过量游离脂肪酸(FFA)、促炎因子、神经酰胺和脂肪因子(adipokine)分泌失调(小编注:脂肪细胞分泌数十种细胞因子,如瘦素、脂联素、酰化刺激蛋白、网膜素和细胞因子等,统称为脂肪因子)促进了肝脏中的脂质储存。例如,过量的FFAs导致肝脏线粒体功能障碍,增加氧化应激,促进氧化磷酸化解偶联,同时激活肝星状细胞的纤维化反应,促进NASH和肝硬化的进展。脂肪组织功能障碍很大程度上是由于男性和女性机体内与年龄相关的性激素和性激素受体表达下降,以及脂肪前体细胞的衰老引起的。这些病理过程会导致脂肪从下半身到上半身以及从皮下到内脏的重新分布,从而导致更多的脂质异位堆积在肝脏中。重要的是,遗传学相关研究的证据表明,与较高皮下脂肪量和较低肝脏脂肪含量相关的有利肥胖基因(小编注:较高的肥胖率,但有相对较好的代谢表型)可能会降低2型糖尿病、心脏病和高血压的风险。
对脂肪萎缩(lipodystrophy)患者的研究表明NAFLD可能是脂肪组织功能障碍的结果(小编注:脂肪萎缩是一类以脂肪组织完全或部分缺失为特征的异质性疾病,可分为先天性或获得性。脂肪丢失的程度与代谢异常的严重度有关。临床上,严重脂肪萎缩患者具有严重的胰岛素抵抗和一组特有表现,如重度高脂血症、进行性肝病和代谢率增高)。遗传性脂肪萎缩的主要特征是皮下脂肪组织功能障碍,导致严重的胰岛素抵抗、内脏肥胖和NAFLD。研究表明,HIV患者或者经过高活性抗逆转录病毒治疗HIV后引起脂肪萎缩的患者存在外周脂肪萎缩、内脏肥胖和严重的胰岛素抵抗、血脂异常和NAFLD。此外,获得性脂肪萎缩也可能在NAFLD中起着重要的作用。最近本文作者报道了一名45岁女性确诊患有获得性脂肪萎缩和严重高脂血症以及NAFLD,并进行了治疗。该患者的病因是基于免疫检查点阻断诱导的下半身皮下脂肪组织严重炎症。
除了脂肪组织失调和活动量减少外,骨骼肌功能受损也显著影响NAFLD病理生理学进程。研究人员正在确定运动引起的代谢反应变化,并探究运动因子(exerkine)在这一过程中的潜在机制。尤其是与运动相关的肌肉因子(myokine)释放对肝脏、脂肪组织、大脑和免疫系统影响的研究,有助于人们更好地理解运动和骨骼肌功能在代谢中的作用,尤其是在NAFLD发展中的作用。
肠道菌群失调也参与NAFLD的发病机制。肠道菌群将难以消化的碳水化合物发酵,为肝脏提供短链脂肪酸等代谢物。然而,在结肠末端中,微生物对多肽和蛋白质的发酵也会产生有害的产物,如支链脂肪酸,这可能会损害人体健康。此外,最近发现人类肠道菌群可以产生乙醇,这可能与NAFLD的临床发病机制相关。
这些研究表明在过去十年中,NAFLD发病机制研究取得了很大的进展。然而,对于那些人会从简单的脂肪变性发展到严重的NAFLD仍然知之甚少。为此,有研究人员专注于鉴定NAFLD相关的生物标志物,以便识别那些可能会进展为NASH和晚期纤维化的患者。例如,研究人员提出一种称为NIS4的非侵入性血液诊断测试,其中包括四个独立的NASH相关生物标志物(microRNA 34A,α2巨球蛋白,HbA1c,YKL-40)。有趣的是,microRNA 34A最近也被认为是一种新的脂肪细胞胰岛素信号抑制剂。此外,肠道微生物组的特征被认为也有助于预测晚期纤维化和肝硬化。
NAFLD作为代谢疾病的结果
虽然大多数NAFLD患者存在胰岛素抵抗,并伴随着心血管代谢疾病风险的升高。但令人意外的是,GCKR(葡萄糖激酶调节因子)、PNPLA3(含Patatin样磷脂酶域蛋白3)和TM6SF2(跨膜蛋白6超家族成员2)突变诱导的NAFLD患者并没有胰岛素抵抗或心血管代谢疾病风险。事实上,增加脂肪肝风险的基因PNPLA3 (rs738409)和TM6SF2 (rs58542926)可以预防心血管疾病。这些“代谢健康型”脂肪肝的发生机制主要与肝脏脂滴重塑和极低密度脂蛋白(VLDL)产生以及分泌改变有关。众多研究表明当饱和脂肪酸被重新定向到合成甘油三酯,代谢前体被用于脂质合成并被储存在甘油三酯中时,肝脏中甘油三酯的积累可以防止脂肪酸诱导的脂毒性。
NAFLD病理生理的异质性
虽然大多数NAFLD患者存在胰岛素抵抗,并伴随着心血管代谢疾病风险的升高。但令人意外的是,GCKR(葡萄糖激酶调节因子)、PNPLA3(含Patatin样磷脂酶域蛋白3)和TM6SF2(跨膜蛋白6超家族成员2)突变诱导的NAFLD患者并没有胰岛素抵抗或心血管代谢疾病风险。事实上,增加脂肪肝风险的基因PNPLA3 (rs738409)和TM6SF2 (rs58542926)可以预防心血管疾病。这些“代谢健康型”脂肪肝的发生机制主要与肝脏脂滴重塑和极低密度脂蛋白(VLDL)产生以及分泌改变有关。众多研究表明当饱和脂肪酸被重新定向到合成甘油三酯,代谢前体被用于脂质合成并被储存在甘油三酯中时,肝脏中甘油三酯的积累可以防止脂肪酸诱导的脂毒性。
NAFLD是代谢性疾病的诱因之一
孟德尔随机化(MR)是使用遗传数据来确定表型和结果之间的因果关系。在分析NAFLD过程中,遗传变异被假定为1)与所关注的风险因素(肝脏脂肪变性)相关,2)独立于结果关联风险因素的混淆因素,3)通过其对风险因素的影响而影响结果(无多效性假设)。如果导致NAFLD的不同途径不涉及脂肪组织功能障碍、胰岛素抵抗、高脂血症或亚临床炎症增加,那么遗传因素决定的NAFLD与心血管代谢疾病之间的因果关系可能不会在MR分析中被发现。在这种情况下,水平多效性(一种遗传变异影响其他性状,这些性状独立于假设暴露而影响结果)可能起作用(小编注:“暴露”指代假定的因果风险因素,有时也称为中间表型,它可以是生物标志物(Biomarker)、人体测量指标(Physical measurement)或任何其他可能影响结果的风险因素(Risk factor))。因此,由于水平多效性,遗传因素引起的NAFLD被发现与2型糖尿病和中心性肥胖(小编注:中心性肥胖是指腹型肥胖,与周围型肥胖(皮下脂肪型肥胖)相对应)风险相关,但与胰岛素抵抗无关。
在对英国生物数据库的另一项MR分析中,研究人员还观察到高肝脏脂肪含量与2型糖尿病风险之间的因果关系;然而在该研究中,在与肝脏脂肪含量相关的10个遗传变异中,促进肝脏脂肪增加的GPAM(甘油-3-磷酸酰基转移酶,位于线粒体)和C2orf16基因(2号染色体开放阅读框16)出乎意料地与2型糖尿病的较低风险相关。GPAM催化甘油三酯合成的第一步。最近发现GPAM的一个错义突变与NAFLD和肝硬化有关,并与血清甘油三酯含量降低有关。在之前的一项研究中,同样的突变被假设导致肝脏甘油三酯含量的增加,并代偿性地增加甘油三酯的利用,以抵消的脂肪积累。C2orf16是一种蛋白质编码基因,与C2orf16相关的疾病包括低β脂蛋白血症。这些结果可能与上述提到的代谢健康型脂肪肝的概念一致,即肝脏甘油三酯合成改变、脂滴重塑、VLDL产生和分泌改变导致肝脏甘油三酯水平升高时,不一定会导致糖脂代谢受损或亚临床炎症增加。
总之,这些结果支持这样一种观点,即在探讨NAFLD与心血管代谢风险的关系时,需要非常仔细地考虑肝脏脂肪变性的不同病理机制。除了这些遗传方法外,基于体内外研究与人类观察性研究相结合的病理生理学结果表明,脂肪肝与高血糖和心血管风险的病理生理学有关。解释这种关系的机制包括肝脏胰岛素抵抗、促动脉粥样硬化的血脂异常以及可能促进心血管疾病和其他心脏/心律失常的促动脉粥样硬化、促凝血和促炎症介质的合成。
最近,针对肝细胞来源的细胞外囊泡(EVs)研究也提供了证据表明脂肪肝在代谢紊乱的病理生理学过程中扮演重要角色。含有miRNAs的EVs响应肝脏脂质过度堆积信号,分泌增加并直接靶向脂肪细胞。例如,含有miRNA let-7e-5p的EVs 通过Pgc1α刺激脂肪生成并抑制脂质氧化,从而增加脂肪细胞脂质积累。此外, NAFLD患者中肝脏脂肪酸刺激分泌miRNA 122,从而调节骨骼肌脂质氧化,并通过使心脏能量稳态失调引起代谢性心肌病。
NAFLD中的肝因子
在研究肝脏脂质积累增加心血管代谢疾病风险的其他病理机制研究时,产生了一种新的假设,即与健康的肝脏相比,脂肪肝具有不同的内分泌功能。类似于有炎症和胰岛素抵抗的脂肪组织脂肪因子分泌失调,脂肪肝中的肝脏可能以不同的方式表达和分泌蛋白质(肝因子)进入机体循环。在2006年,研究人员开始研究肝细胞因子fetuin-A在NAFLD中的肝脏表达和对代谢的影响,揭示了其在不同组织和器官中的有害信号功能。
目前已经鉴定和研究了20多种肝细胞因子,并在体外和动物实验中确定了它们在脂肪肝中的表达及其对代谢的影响。在本篇文章中,研究人员将重点放在通过临床重复研究表明与NAFLD患者心血管代谢风险密切相关、或在偶发疾病的前瞻性研究或遗传分析中显示有强相关性的肝细胞因子。其他肝细胞因子在人类心血管代谢病理生理中的作用有待进一步详细评估(表1)。此外,研究人员更广泛地描述了饮食和基因诱导的脂肪肝如何演变,以及涉及营养物质、激素和分泌因子的器官相互作用如何影响脂肪肝和心血管代谢疾病的病理生理学关系(图1)。
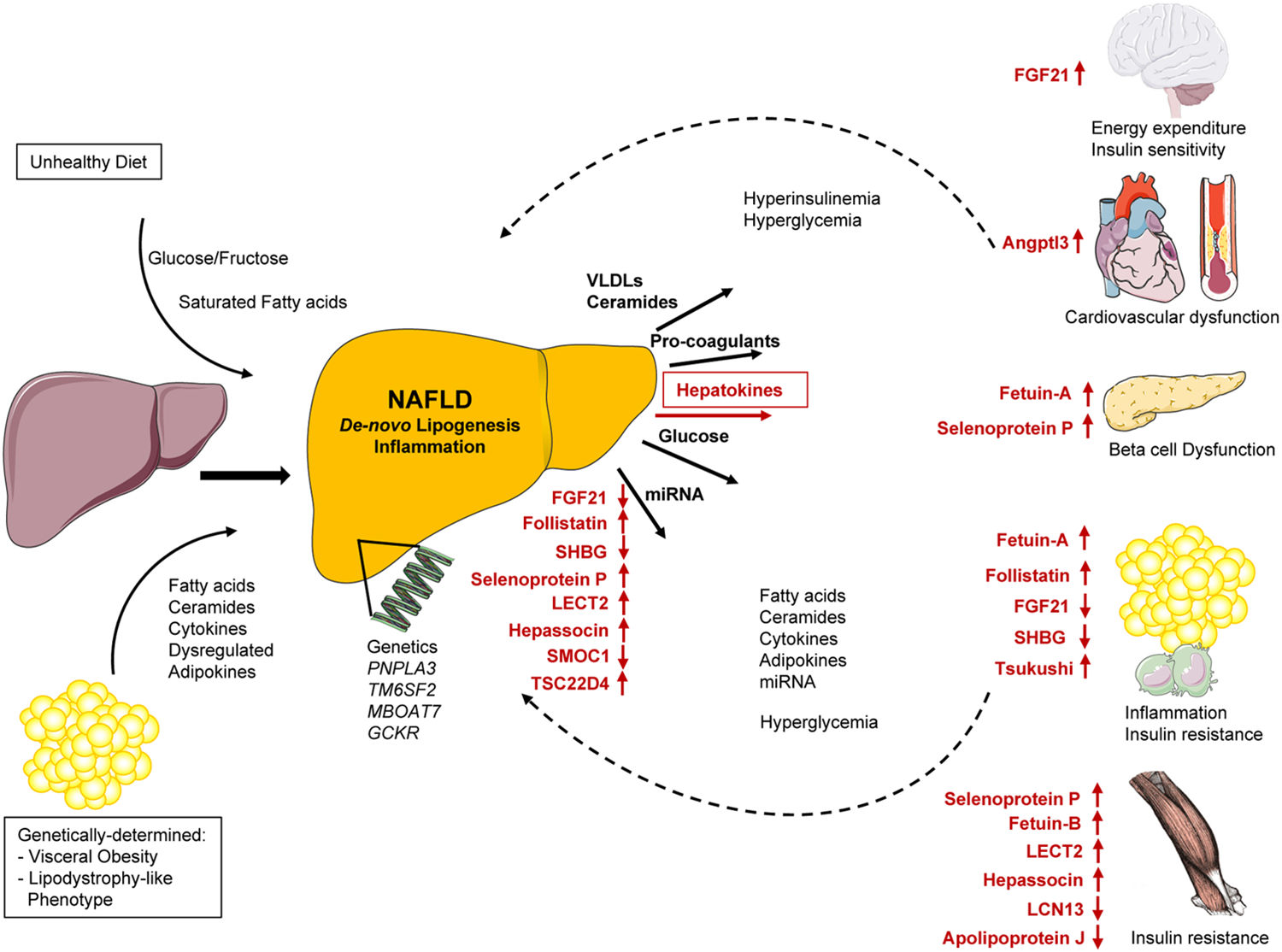
图1 | NAFLD的诱因和心血管代谢结果
热量摄入增加,特别是葡萄糖、果糖和饱和脂肪酸过量摄入的不健康饮食引起正能量平衡(能量摄入大于消耗),导致肝脏中脂质从头合成和肝脏炎症增加。随着,这一过程被脂肪萎缩和内脏脂肪组织扩张的表型所放大,导致脂肪酸和神经酰胺的释放增加以及细胞因子和脂肪因子的失调。肝脂质堆积、炎症和纤维化的遗传易感性也参与NAFLD的发病机制,尽管其代谢效应更广泛。通过增加/减少极低密度脂蛋白(VLDLs)和不同数量神经酰胺的分泌,促凝血素分泌增加,葡萄糖输出增加,microRNAs和肝因子分泌失调,脂肪肝影响重要的代谢器官和组织以及心血管系统。肝因子所示的箭头表示不同肝因子介导的器官功能的增加/降低。脂肪肝内分泌功能所带来的心血管代谢病变也影响NAFLD的进展。
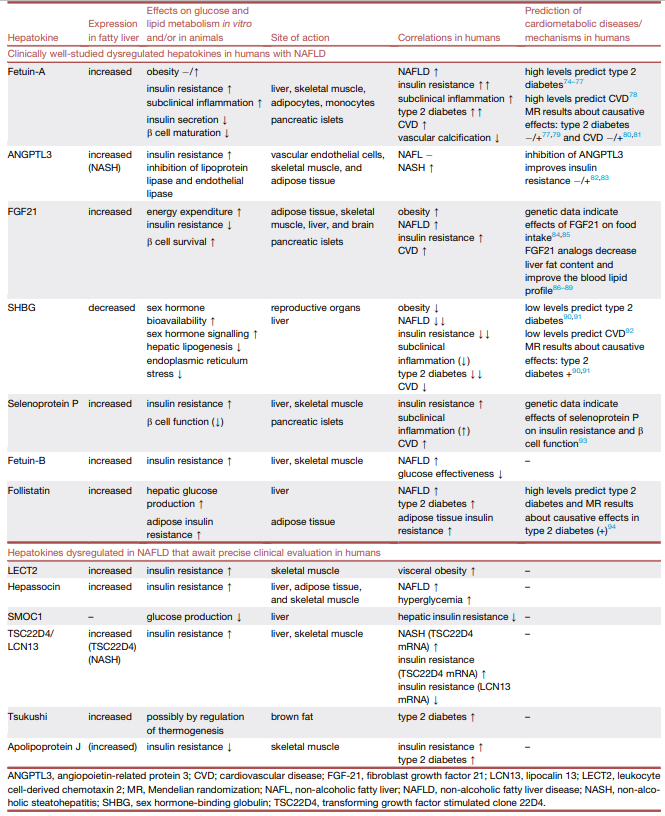
表1 |NAFLD中的肝因子及其代谢功能
临床NAFLD患者中充分研究的失调肝因子
Fetuin-A
胎球蛋白-A(Fetuin-A)是研究最广泛的人类肝因子。Fetuin-A主要表达于肝脏,并由肝脏分泌。FFAs通过NF-kB信号和葡萄糖通过ERK1/2信号均能上调其在肝脏中的表达。Fetuin-A在肝脏和骨骼肌中抑制胰岛素受体酪氨酸激酶。Fetuin-A与脂肪酸共同作用,能够激活Toll样受体4,可诱导脂肪细胞和巨噬细胞的炎症信号和胰岛素抵抗。此外,Fetuin-A通过c-Jun N-末端激酶和Ca2+依赖信号通路损害葡萄糖诱导的胰岛素分泌,从而破坏胰腺β细胞的功能成熟。Fetuin-A的表达被E3泛素蛋白连接酶FBXW7下调,这可能是一个维持葡萄糖稳态的重要机制。
在人类中,来自不同研究小组的几项研究表明体循环内高水平的fetuin-A与脂肪肝和胰岛素抵抗有关。重要的是,体内外实验数据证明,fetuin-A血浆水平与胰岛素抵抗有关,特别是当血浆FFAs升高时。这种关系在NAFLD患者中比在健康对照组中更强。在生活方式干预或噻唑烷二酮类药物治疗引起的减重中,血浆中fetuin-A水平下降,同时肝脏脂肪含量降低,但使用二甲双胍无此效果。在大型临床队列研究中,血浆中fetuin-A水平升高与2型糖尿病和心血管疾病的发病风险增加相关,并独立于已被发现的心血管代谢风险标记物。基于部分MR分析结果,fetuin-A水平与2型糖尿病和心血管疾病风险之间存在因果关系,但在另外一些MR分析中则没有显示这种因果关系。例如,Nurses的健康研究中显示二者之间有强相关性,而CHARGE人群研究则显示无相关性。可见由于不同人群间存在异质性,解读MR分析结果必须谨慎。另外,这些研究没有解释体循环中fetuin-A与FFAs之间的相互关系,而这是fetuin-A诱导亚临床炎症的重要机制。此外,由于fetuin-A还抑制血管钙化,fetuin-A的这种保护作用可能抵消其促炎作用,特别是在心血管风险较高的患者中。
ANGPTL3
血管生成素样蛋白(angiopoietin-like 3,ANGPTL1-8)是调节脂质代谢的分泌型糖蛋白(小编注:血管生成素样蛋白(ANGPTLs)是一类与血管生成素结构相似的蛋白家族。目前已经发现了8个ANGPTLs,即ANGPTL1-8。ANGPTLs不与血管生成素靶向的受体Tie-1/2结合,通常被认为是孤儿配体。与血管生成素相似,ANGPTLs能够有效地调节血管生成。)。ANGPTL3由肝脏特异性表达和分泌。肝脏X受体(LXR)上调ANGPTL3表达,而胰岛素、瘦素、过氧化物酶体增殖物激活受体-β(PPARβ)、他汀类和甲状腺激素下调ANGPTL3表达。ANGPTLs可抑制脂蛋白脂肪酶(LPL)活性。健康情况下,LPL活性促进甘油三酯在臀肌部位积累而非病理性的内脏部位储存,从而改善脂质代谢和胰岛素敏感性。因此,ANGPTL3水平升高可能通过抑制LPL活性而增加心血管代谢风险。
ANGPTL3水平在NASH患者中升高,但在单纯性脂肪变性患者中没有。与此一致的是,一项对854例脂肪肝患者与610例对照组的荟萃分析显示,脂肪肝患者血浆ANGPTL8升高,但ANGPTL3或ANGPTL4未升高。无论如何,抑制ANGPTL3对动物的胰岛素抵抗和脂肪肝以及人类的血脂异常都是有益的。在空腹高甘油三酯血症、2型糖尿病和肝脂肪变性患者中,利用ANGPTL3抑制剂可靶向肝脏降低空腹血浆甘油三酯水平(小编注;Vupanorsen 是一种靶向肝脏的 N-乙酰半乳糖胺偶联反义寡核苷酸,可选择性抑制肝脏中ANGPTL3蛋白表达),但不能降低肝脏脂肪含量或改善血糖稳态。由于本研究样本量相对较小(N=105),可能不足以确认抑制ANGPTL3对肝脏脂肪变性和葡萄糖代谢的影响。
FGF21
成纤维细胞生长因子21(Fibroblast growth factor 21,FGF21)是动物中研究最广泛的肝因子之一。它在禁食和进食过程中具有重要的代谢调节作用。针对FGF21在预防心血管代谢疾病方面的作用,FGF21治疗肥胖和糖尿病的小鼠/大鼠可降低血糖和血脂水平,改善肝脏和外周胰岛素敏感性(这些代谢改善部分独立于体重减轻、脂肪减少或肝脏脂肪变性改善),同时增加机体能量消耗。无论如何,很难在人体上确定FGF21对机体代谢的这些有益作用。有充分的证据表明,肥胖、胰岛素抵抗、NAFLD或2型糖尿病患者中FGF21水平升高。有理论认为肝脏中FGF21产生和释放的增加与肝脏脂质和碳水化合物信号通路升高有关。相比之下,缺乏肝脏胰岛素受体底物IRS1和IRS2的小鼠表现出强烈的肝脏胰岛素抵抗,同时表现为肥胖改善和体循环FGF21降低。此外,肥胖和胰岛素抵抗被认为会导致啮齿动物和人类中的FGF21抵抗状态。在临床研究中,FGF21类似物会降低血浆甘油三酯浓度,增加HDL胆固醇水平,但没有降低血糖或改善胰岛素敏感性的作用。
例如,一项针对肥胖和2型糖尿病患者的随机、安慰剂对照、双盲的概念验证试验发现,使用FGF21短效类似物LY2405319能够改善患者血脂异常,减轻患者体重,降低空腹胰岛素水平,增加脂联素水平,并有降低血糖的趋势。在另一项针对超重/肥胖并伴随2型糖尿病患者的安慰剂对照、多重剂量递增临床实验中,FGF21长效类似物PF-05231023治疗显示患者体重减轻,血浆脂蛋白改善,脂联素水平升高,而血糖控制没有改善。FGF21在小鼠和人类中组织表达和生理功能的差异可能是这些出人意外的临床数据背后的原因。然而,一项随机、双盲、安慰剂对照、平行组设置的2期临床研究表明,乙二醇化FGF21治疗的NASH患者肝脏脂肪含量和血液纤维化生物标志物减少。该研究包含了活检证实患有NASH患者(纤维化1-3期)且肝脏脂肪变性比例大于10%的患者,与安慰剂组比较,每天接受10 mg pegbelfermin治疗(小编注:pegbelfermin是一种FGF21类似物)组(-6.8% vs -1.3%;P = 0.0004)和每周接受20 mg pegbelfermin治疗组(-5.2% vs -1.3%;P = 0.008)患者的肝脏脂肪比例显著降低。与安慰剂相比,在一项使用FchFGF21融合蛋白LLF580的临床研究中也观察到肝脏脂肪比例大幅减少。FGF21改善高血糖、血脂异常、NASH和其他合并病症的有益作用部分归因于它在肝细胞中的作用,也可能由脂肪组织中脂联素诱导或通过脑-肝轴介导。最近,CNOT6L脱腺苷酶被确定为肝脏FGF21和生长分化因子15(GDF15)的重要抑制剂。因此,靶向CNOT6L可能是治疗代谢性疾病的一种有效方法。
SHBG
性激素结合球蛋白(sex hormone-binding globulin,SHBG)主要由肝脏表达和分泌。2007年,研究发现葡萄糖和果糖可以通过下调肝细胞核因子-4α(HNF-4α)来减少人类肝细胞产生SHBG。此外,肿瘤坏死因子α(TNFα)和IL-1β通过MEK-1/2和JNK降低HNF-4α,从而下调SHBG的表达。甲状腺激素、脂联素和油酸可上调SHBG的表达,而胰岛素对SHBG表达的影响尚不清楚。SHBG调节循环中类固醇激素的水平和生物活性,包括睾酮、二氢睾酮和雌二醇。在性激素中,雄激素通常是SHBG的首选配体。女性SHBG水平大多是男性的两倍。没有观察到睾酮与的SHBG结合存在性别或肥胖方面的显著差异;然而,在重度肥胖的男性患者中,SHBG结合雌二醇的能力增强。游离的SHBG与G蛋白偶联的SHBG-R(SHBG受体)结合,而SHBG受体在细胞表面被雌二醇和5α-雄甾烷-17b-醇-3-酮激活(小编注:5α-androstan-17b-ol-3-one是一种雄激素,又称为二氢睾酮(DHT)。它是由睾丸、前列腺和肾上腺皮质合成的一种生物活性物质,具有很强的雄性激素作用),进而激活腺苷酸环化酶。此外,SHBG可能与生殖组织中的内吞受体巨乳蛋白相互作用,并刺激SHBG结合的雄激素和雌激素的内吞作用。
SHBG会对代谢产生有益的作用。在两种NAFLD小鼠模型中,SHBG过表达通过激活ERK-1/2通路降低PPARγ来抑制肝脏脂肪生成。此外,SHBG通过降低IRE1α表达来降低ATF6、CHOP和BIP的活性,从而避免内质网应激并延缓其进展。一项荟萃分析发现NAFLD患者中循环SHBG水平低于健康对照组,这与动物实验中的研究结果一致。使用精确的表型分析方法,研究人员发现低水平的SHBG与脂肪肝有关,而在与体重减轻相关的肝脏脂肪变性缓解过程中SHBG水平的增加,并与内脏肥胖无关。此外,研究人员发现高循环水平的SHBG预防2型糖尿病发展的机制可能与肝脏胰岛素抵抗改善有关。最重要的是,两项大型MR研究提供了强有力的证据表明高水平的SHBG可以保护男性和女性免受2型糖尿病的风险。相比之下,低水平的SHBG与更高的心血管疾病发生风险相关。
Selenoprotein P
在2010年,人们发现糖基肝因子硒蛋白P(Selenoprotein P)在肝脏脂肪变性中表达失调。其在肝脏中的表达被葡萄糖和棕榈酸盐上调,这可能与内质网应激诱导的JNK通路激活有关。相反,胰岛素会下调硒蛋白P的表达。二甲双胍也可通过激活AMPK降低其表达。硒蛋白P通过影响IRS1水平抑制肝细胞和肌细胞的胰岛素信号,并抑制AMPK的激活。此外,硒蛋白P可以减少小鼠中葡萄糖诱导的胰岛素分泌。在一项样本量相对较小的人类研究中,NAFLD患者和2型糖尿病患者血浆中硒蛋白P水平升高。因此,硒蛋白P与高血糖、胰岛素抵抗和颈动脉内膜-中膜厚度相关;然而,在一项荟萃分析中,硒蛋白P水平升高与2型糖尿病、代谢综合征指标或NAFLD的关系很弱或不存在。硒蛋白P血浆1基因(SEPP1)的遗传变异与急性胰岛素反应和胰岛素敏感性相关;然而,目前没有MR分析研究硒蛋白P血浆水平与2型糖尿病或心血管疾病发病率间的关系。因此,基于硒蛋白P在动物实验中对葡萄糖代谢的重要作用,有必要进行更多的研究来更好地了解硒蛋白P在人体代谢中的作用。
Fetuin-B
胎球蛋白B(Fetuin-B)主要由脂肪肝产生和分泌,并被发现在培养的肝细胞和肌管中诱导产生胰岛素抵抗。胎球蛋白B会导致小鼠葡萄糖耐受不良,其肝脏特异性敲除可提高葡萄糖耐量而不影响胰岛素敏感性。胎球蛋白B可加重HepG2细胞脂质积累和小鼠肝脂肪变性。对3800名NAFLD患者和3614名对照组的荟萃分析和荟萃回归显示,肝脏脂肪含量增加的受试者中血浆胎球蛋白B水平升高。动物和人体数据表明,胎球蛋白B可能通过一种未知的机制调节葡萄糖代谢。
FST
糖蛋白卵泡抑素(Follistatin,FST)在全身许多组织中都有表达,但肝脏被认为是负责产生循环中FST的主要器官。FST通过抑制TGF-β超家族成员肌肉生长抑制蛋白(myostatin)和激活蛋白(activin),对生殖和骨骼肌生长具有强烈的调节作用。在小鼠和人类中,当运动和禁食引起高胰高血糖素/胰岛素比,或肝脏胰岛素抵抗下FoxO1激活时,肝脏分泌FST。FST通过可变剪切产生两种异构体,包括膜结合的Fst288和循环中的Fst315,它们能够干扰激活蛋白和肌肉生长抑制蛋白与受体结合以及Smad2/3转录因子的磷酸化。过表达FST对小鼠产生多样的影响:骨骼肌特异性过表达Fst288会阻止肥胖db/db小鼠中β细胞的损失,以维持葡萄糖耐量而不减少脂肪;然而,在高脂饮食中,全身过表达Fst315可以改善糖耐量,同时改善肥胖。无论如何,FST在肝脏(其自然表达位点)的过表达会引起白色脂肪组织胰岛素抵抗和脂解,从而将FFAs和甘油输送到肝脏,导致肝脏不受控制的葡萄糖生成和葡萄糖耐量受损。在高血糖和高脂喂养的肥胖小鼠中,抑制FST恢复了葡萄糖耐量和白色脂肪组织胰岛素信号传递,并抑制了胰岛素引起的肝脏葡萄糖生成。此外,高水平FST可能通过诱导脂肪组织的胰岛素抵抗来促进人类的NAFLD。最近,研究人员发现FST可以剂量依赖性的诱导脂肪细胞FFA释放增加。因此,肝脏FST可能将白色脂肪组织的脂解与不受控制的肝脏葡萄糖产生和NAFLD/NASH结合起来。
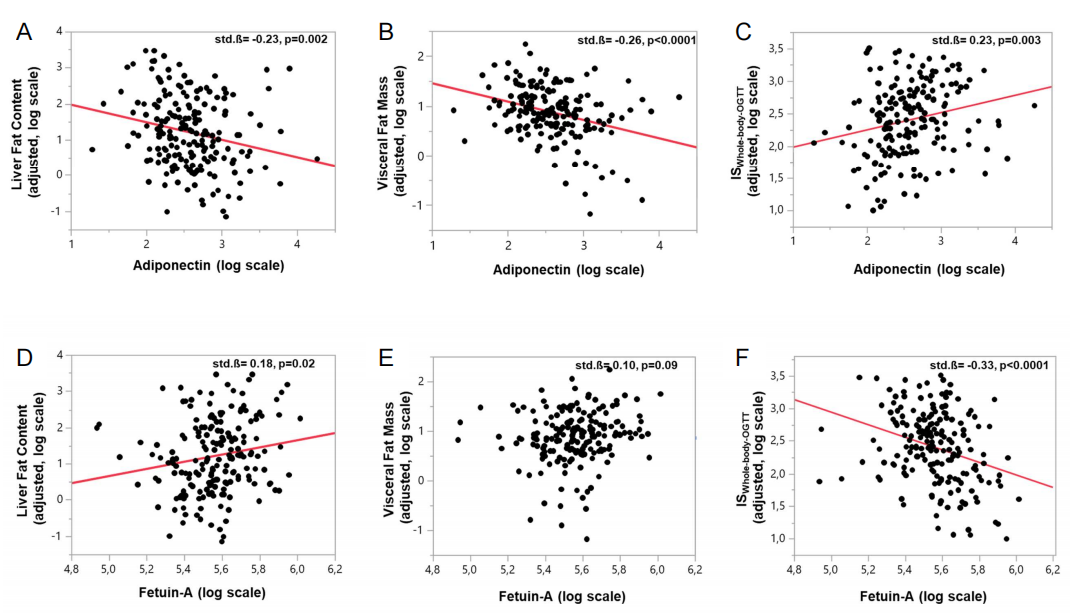
利用与FST水平密切相关的葡萄糖激酶调节蛋白基因(glucokinase regulatory protein gene)突变研究,研究人员发现FST可能参与2型糖尿病的发病机制。为了验证人类FST与白色脂肪组织胰岛素敏感性之间的关系,研究人员调查了TUEF/TULIP(Tübingen家庭研究/Tübingen生活方式干预项目)患者中的FST水平。结果发现,NAFLD患者FST水平较高,且与BMI(r = 0.27, p = 0.0001)、总脂肪量(r = 0.28,p<0.0001),内脏脂肪量(r = 0.18,p = 0.008),肝脏脂肪含量(r = 0.23, p = 0.0008),以及口服葡萄糖耐量试验期间0、60和120分钟时FFAs水平(r = 0.22-0.28,p ≤0.001)显著相关。相比之下,FST水平与脂肪胰岛素敏感性呈负相关(r =- 0.26,p = 0.0002)。这种相关性对腿部脂肪量的改变很敏感,表明FST可能主要损害腿部脂肪的胰岛素敏感性。由于循环中FFAs的再酯化是NAFLD患者肝脏甘油三酯的重要来源,因此,脂肪胰岛素敏感性被FST损坏后,可能通过将FFAs转移到肝脏来刺激NAFLD的发展。
NAFLD中需要临床评估的新失调肝因子
白细胞衍生趋化因子2(Leukocyte cell-derived chemotaxin 2,LECT2)在脂肪肝中表达异常,但尚未系统研究其与临床表型或心血管代谢疾病的关系。LECT2主要由肝脏表达和分泌,但脂肪组织、神经元和白细胞也可分泌。体外和动物实验数据表明,LECT2抑制门静脉血管生成,促进肝窦毛细血管形成,并加重肝纤维化。它还会损害骨骼肌和脂肪组织中的胰岛素信号。在人类中,血浆中LECT2水平的升高与内脏肥胖密切相关,但与经腰围调整后的NAFLD无关。在一项规模相对较小的研究中,循环LECT2与血糖水平或动脉粥样硬化的早期标志物无关。还需要更大规模的研究来调查LECT2是否可以作为NAFLD相关胰岛素抵抗治疗或动脉粥样硬化标志物的潜在靶点。
HPS
肝素(Hepassocin,HPS)主要在肝脏中表达,并对离体的肝细胞具有促进有丝分裂的活性。它可以保护大鼠免受肝损伤。葡萄糖通过STAT3和PP2A-HNF1途径增加HepG2细胞的HPS。HPS可诱导小鼠产生胰岛素抵抗,这可能涉及骨骼肌中的ERK1/2和EGFR/JNK通路。HPS还通过ERK1/2依赖通路促进肝脏脂质积累。NAFLD患者血清HPS水平升高,与空腹血糖相关,但与空腹胰岛素血症无关。
SMOC1
SPARC相关模块钙结合蛋白1 (SPARC-related modular calcium-binding protein 1,SMOC1)是一种在许多组织中发现的糖蛋白。SMOC1主要由肝脏分泌,其基因表达和分泌由葡萄糖通过ChREBP依赖途径上调。研究发现,SMOC1可抑制肝脏中的CREB (cAMP应答元件结合蛋白1)信号通路,降低糖异生基因表达并抑制肝脏葡萄糖输出。此外,SMOC1被证明可以增加小鼠骨骼肌对葡萄糖的摄取;然而机制尚不明确。低血糖-高胰岛素钳夹试验结果显示,在血糖控制正常的瘦小鼠中,SMOC1可增加胰岛素对肝脏葡萄糖输出的抑制作用,但并不影响葡萄糖消耗速率。因此,SMOC1可能通过作用于肝脏改善胰岛素敏感性。在人类中,与胰岛素敏感个体相比,胰岛素抵抗患者的SMOC1血浆水平较低,并与肝脏胰岛素敏感性呈正相关;然而,血浆SMOC1水平与肝脏脂肪含量之间未观察到明显相关性。肝脏SMOC1表达在NAFLD不同阶段无显著差异。通过MR分析表明循环中SMOC1水平与2型糖尿病或血糖之间没有因果关系。
TSC22D4/LCN13
转化生长因子-刺激克隆22D4(Transforming growth factor-stimulated clone 22D4, TSC22D4)是一种广泛表达的蛋白,被认为与糖皮质激素和应激信号、细胞增殖和凋亡有关。在糖尿病小鼠模型中,抑制肝脏中的TSC22D4可降低高血糖、改善受损的葡萄糖不耐受和胰岛素抵抗。在外源性胰岛素注射或空腹再进食情况下,TSC22D4表达降低伴随着肝脏Akt T308/S473磷酸化的增强。此外,TSC22D4抑制全身葡萄糖稳态,至少部分通过直接转录抑制能够抑制骨骼肌胰岛素敏感性的小分泌蛋白脂素13 (lipocalin 13,LCN13)。在人类中,LCN13的肝脏mRNA表达与胰岛素敏感性呈正相关,而TSC22D4的肝脏mRNA表达与胰岛素敏感性呈负相关。目前,肝脏TSC22D4表达的调控尚不清楚,因为TSC22D4 mRNA的表达肥胖患者中升高,无论是否存在脂肪变性或NASH。
TSKU
Tsukushi(TSKU)是一种富含亮氨酸的小蛋白聚糖,是一个小鼠和人类在患NAFLD或肝损伤期间肝脏表达和循环中增加的肝因子。其在小鼠体内的上调机制可能与内质网应激和炎症有关。TSKU缺陷小鼠的棕色脂肪组织显示出增强的肾上腺素能信号和产热作用,从而减少饮食诱导的肥胖、胰岛素抵抗和肝脏脂肪变性。在一项小规模研究中,2型糖尿病患者血清TSKU水平升高;然而,TSKU在心血管代谢疾病病理生理学中的作用尚不清楚。
ApoJ
载脂蛋白J(Apolipoprotein J,ApoJ,又名clusterin,凝聚素)在全身广泛表达和分泌、但主要由肝脏表达和分泌的分泌型硫化糖蛋白(小编注:APOJ可以在脂肪、脑等多种组织中表达和分泌,而肝脏特异性APOJ敲除小鼠体内,血液循环中的APOJ几乎不存在,说明野生型小鼠血循环中的APOJ主要由肝脏分泌)。肝脏来源的ApoJ在骨骼肌细胞表面与其受体LRP2(LDL receptor-related protein 2,LDL受体相关蛋白2)结合。ApoJ结合通过特异性驱动胰岛素受体内化来放大胰岛素作用。在小鼠中,过表达ApoJ可预防西方饮食诱导的肥胖和NAFLD。小规模人体研究表明,ApoJ血浆水平在肥胖、代谢综合征、胰岛素抵抗和2型糖尿病中上调;然而,在人类中,ApoJ与胰岛素敏感性或肝脏脂肪变性之间的关系尚不清楚。
NAFLD中失调的脂肪/肝因子
在NAFLD中失调的、具有代谢信号特性的几种肝脏分泌蛋白也在脂肪组织、肺和肠中强烈表达和分泌。其中包括视黄醇结合蛋白4 (retinol-binding protein 4,RBP4)、色素上皮衍生因子(pigment epithelium-derived factor,PEDF)、生长分化因子15 (growth differentiation factor 15, GDF15)、二肽基肽酶-4 (dipeptidyl peptidase-4,DPP4)、类血管生成素4(angiopoietin-like 4,ANGPTL)和ANGPTL8。体内外实验发现这些肝/脂肪因子在调节糖脂代谢方面有重要作用;然而,在大多数情况下,它们对心血管代谢疾病的影响是不完全清楚的。最近,与运动相关的肌肉因子鸢尾素(FNDC5)具有高度同源性的纤维连接蛋白III型结构域包含蛋白4 (fibronectin type III domain-containing protein 4,FNDC4)也被认是一种可以调节糖脂代谢的脂肪因子和肝因子。
肝因子和脂肪因子对胰岛素抵抗的聚类分析
研究肝脏脂肪变性中肝因子失调的代谢作用,揭示了脂肪肝如何调节糖脂代谢和亚临床炎症。目前,重要的是整合这些知识来预测代谢性疾病的进展,并在病人中进行精准医疗。这可能有助于更好地区分脂肪肝和内脏脂肪在胰岛素抵抗和慢性非传染性疾病病理生理学中的作用。在Dallas心血管研究(小编注:Dallas心脏研究是一项大型、多种族人群随访研究,研究对象选自Dallas心脏研究的未选择人群样本,共纳入2924名成年人,无ASCVD(动脉粥样硬化性心血管疾病),年龄30~65岁,平均年龄43岁,女性占57%,黑色人种占49%;通过血液样本测定受试者的HDL-C、HDL粒子数(HDL-P)和胆固醇流出能力(CEC);随访中位时间为9.4年。研究主要重点事件为ASCVD,包括初发的非致死性心肌梗死、非致死性脑卒中、心源性血运重建和心源性死亡。)中,内脏肥胖(而不是通过MR技术精确测定的脂肪肝)与糖尿病前期和糖尿病的发病率有关。这些发现表明,单独的脂肪肝可能不是糖尿病风险的重要因素。此外,在Dallas心血管研究中,只有高内脏脂肪量(无论肝脏脂肪含量高低)的表型与心血管疾病风险增加相关。相比之下,低内脏脂肪量/高肝脏脂肪含量与2型糖尿病风险增加相关。先前的研究表明,基因决定的脂肪肝独立于胰岛素抵抗,甚至可以预防糖尿病和心血管疾病。因此,将“代谢健康”型脂肪肝与代谢不健康的脂肪肝区分开来,对于我们了解脂肪肝在心血管代谢疾病中发挥的作用至关重要。
先前的研究表明,脂肪肝和内脏肥胖的精确诊断可能有助于改善基于表型的早期糖尿病亚群分层。通过类似于识别糖尿病聚类的策略,研究人员发现,899个人分成了6组2型糖尿病风险增加的人群,其中有2组NAFLD患病率很高(第5组100%,第6组75%)。第5组和第6组的糖尿病、肾病和全因死亡率也较高;这两组患者也有非常高的内脏脂肪量(第5组为5.73 L,第6组为5.64 L)。此外,利用肝脏、胰腺、肌肉和内脏中脂质含量的k均值聚类(小编注:k均值聚类算法是最简单也最常用的聚类算法之一。它试图找到代表数据特定区域的聚类中心。算法交替执行以下两个步骤: 将每个数据点分配给最近的聚类中心,然后将每个聚类中心设置为所分配的所有数据点的平均值。如果聚类的分配不再发生变化,那么算法结束。K-Means的目标是确保“聚类内差异小,聚类外差异大”,所以可以通过衡量聚类内差异来衡量聚类的效果),研究人员确定了四个脂肪分布簇。其中与糖尿病发病率最密切的类群具有最高的肝脏脂肪含量和内脏脂肪量。
基于对肝脏脂肪含量、内脏脂肪量、肝因子和脂肪因子的k均值聚类,研究人员提出根据胰岛素抵抗患者的脂肪肝和内脏肥胖对其病理生理学的不同进行分类。研究人员重新分析了先前发表的来自Tübingen糖尿病家族185名受试者的研究数据,对四个代谢参数进行了分组:胎球蛋白A和脂联素的循环水平、肝脏脂肪含量和内脏脂肪量。其中,研究人员重点关注循环胎球蛋白A和脂联素水平,因为在EPIC(欧洲癌症和营养前瞻性调查)研究和护士健康研究中发现这两个蛋白质是2型糖尿病发病的独立相关因素。
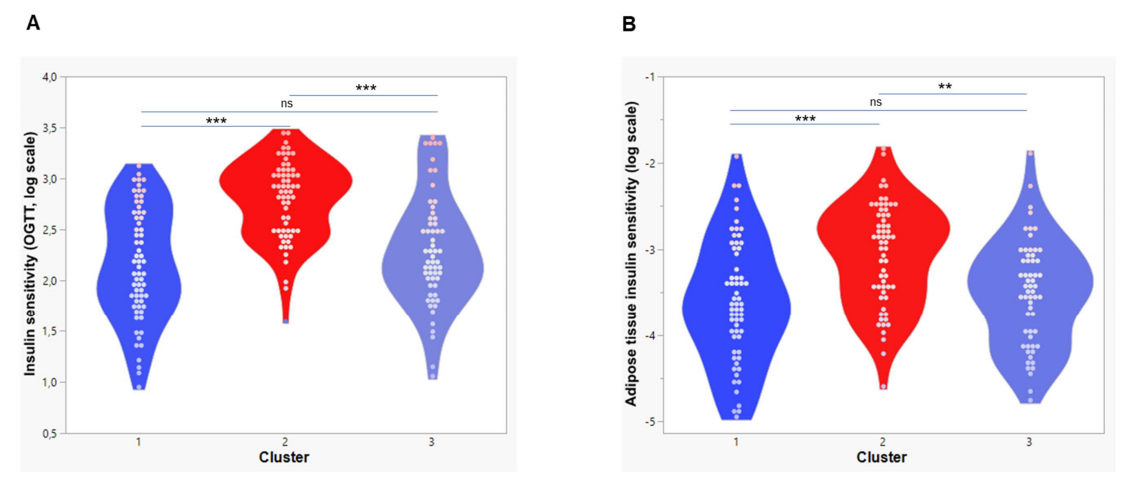
K均值聚类分析揭示了三个信息丰富的聚类。与聚类2相比,聚类1和聚类3具有相似但较低的全身胰岛素敏感性,以及相似的肝脏和内脏脂肪含量升高(图2A、2C和2D)。有趣的是,聚类2中相对较高的脂联素水平与相对较低的肝脏脂肪含量和内脏脂肪量相关(图2C-2E)。值得注意的是,聚类1中的患者血浆胎球蛋白A水平最高,这与其具有最高的肝脏胰岛素抵抗有关(图2B和2F)。三个聚类之间关键的表型差异在雷达图中展示(图3)。因此,代谢不良的脂肪肝相关胰岛素抵抗的病理生理学特征(以高胎球蛋白A水平为特征)可能不同于内脏肥胖相关的胰岛素抵抗的病理生理学特征(以低血浆脂联素水平为特征)。循环中胎球蛋白A水平(而不是脂联素水平)与肝脏胰岛素抵抗的相关性支持这一假设(辅表1;辅图1)。预估的脂肪组织胰岛素敏感性(辅图2B)和低葡萄糖-高胰岛素钳夹试验得出的胰岛素敏感性(图2A)在聚类1和聚类3之间没有差异。由于研究人员在钳夹实验中使用了相对较高的胰岛素剂量,因此在该钳夹实验中测得的胰岛素敏感性主要代表葡萄糖清除的胰岛素敏感性。代谢不良的脂肪肝相关胰岛素抵抗可能与内脏肥胖相关胰岛素抵抗的病理生理学不同,这一假设需要在动物研究和人体研究中进行验证,并使用示踪剂方法精确测定组织特异性的胰岛素抵抗。

![]()
(A-B)胰岛素敏感性和(C-F)聚类参数。在185名2型糖尿病风险增加的受试者中,k均值聚类分析根据(C)内脏脂肪含量,(D)肝脏脂肪含量,(E)脂肪因子:脂联素和(F)肝因子胎球蛋白A参数确定了3个聚类。颜色编码以蓝色表示低值,以灰色阴影表示平均值,以红色表示高值。不同聚类间的p值用Student’s t-test计算得出(*p < 0.05, **p < 0.001, ***p < 0.0001)。插入部分描述了聚类分析方法和聚类结果的三维双标图。
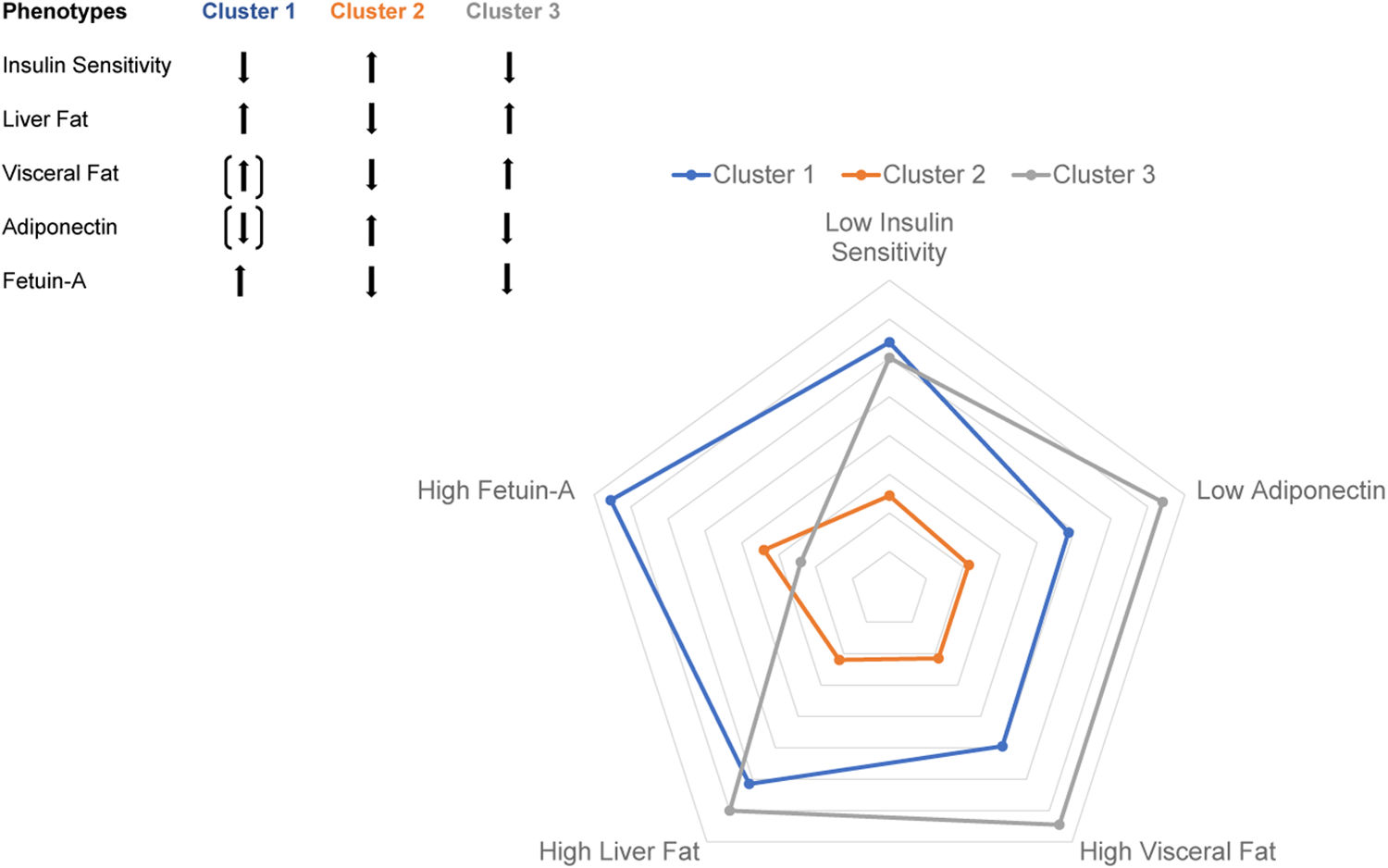
本图描述的是胰岛素敏感性参数Z评分的中位数,由频繁采样的口服糖耐量试验测量;肝脏脂肪含量;内脏脂肪量;脂联素水平;和胎球蛋白A水平测量得出。胰岛素敏感性和脂联素水平定向翻转产生不良变量效应。插入部分描述了这3个集群中的参数是增加还是减少。
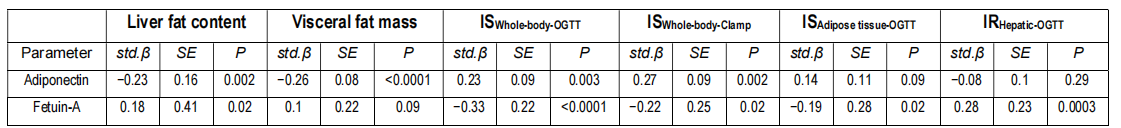
数据根据年龄和性别进行了调整。有统计学意义的关系(p<0.05)用粗体表示。IS,胰岛素敏感性;IR,胰岛素抵抗。
辅图1 | 循环脂联素和胎球蛋白A与肝脏脂肪含量、内脏脂肪量和胰岛素敏感性测定的关系
在185名2型糖尿病风险增加的受试者中,k均值聚类分析根据肝脏脂肪含量、内脏脂肪量、脂肪因子脂联素和肝因子胎球蛋白A的参数确定了3个聚类。
总结
研究表明NAFLD是胰岛素抵抗和高血糖产生的重要结果,这些过程主要是由营养过剩和不健康的饮食以及身体脂肪分布不均衡的遗传倾向引起的。过去10年进行的研究表明,NAFLD也可能在胰岛素抵抗和心血管代谢疾病的发病机制中发挥重要作用。了解肝因子失调在NAFLD中作用的体内外研究为这一假设提供了主要的证据支持。然而在大多数情况下,关于肝因子在NAFLD中作用的研究仍缺少可靠的人类临床数据,而收集这些信息非常重要。目前,学会如何利用已有重要器官因子(包括脂肪因子、肌肉因子和肝因子)的研究结论,可能有助于我们更好地理解内脏肥胖、功能失调的骨骼肌和脂肪肝在胰岛素抵抗的病理生理学中的作用(图4)。在这方面,出于诊断目的,对脂肪因子、肌肉因子和肝因子的检测可用于更好地了解患者的胰岛素抵抗主要由白色脂肪组织、骨骼肌还是肝脏的代谢失调所驱动。此外,如果诊断为脂肪肝,肝因子的测定可能有助于区分代谢健康的脂肪肝与代谢不良的脂肪肝。
研究人员的聚类分析结果表明,与代谢不良的脂肪肝相关的胰岛素抵抗的特征是高胎球蛋白A水平,这种表型可能不同于内脏肥胖相关胰岛素抵抗的表型,后者的主要特征是低血浆脂联素水平。了解肝因子是否失调以及失调程度可能有助于进行治疗指导。例如,与循环中胎球蛋白A升高相关的胰岛素抵抗和脂肪肝最好使用吡格列酮治疗,尤其在肥胖不是患者主要问题的情况下。此外,一旦FGF21类似物被批准用于代谢健康受损的治疗,可能对胰岛素抵抗及伴随的脂肪肝、血脂异常和低能量消耗相关的暴饮暴食有很好的治疗效果。未来肝因子研究领域的发展可能会揭示许多其他诊断和治疗策略,有助于在临床实践中更好地实施精准医疗。
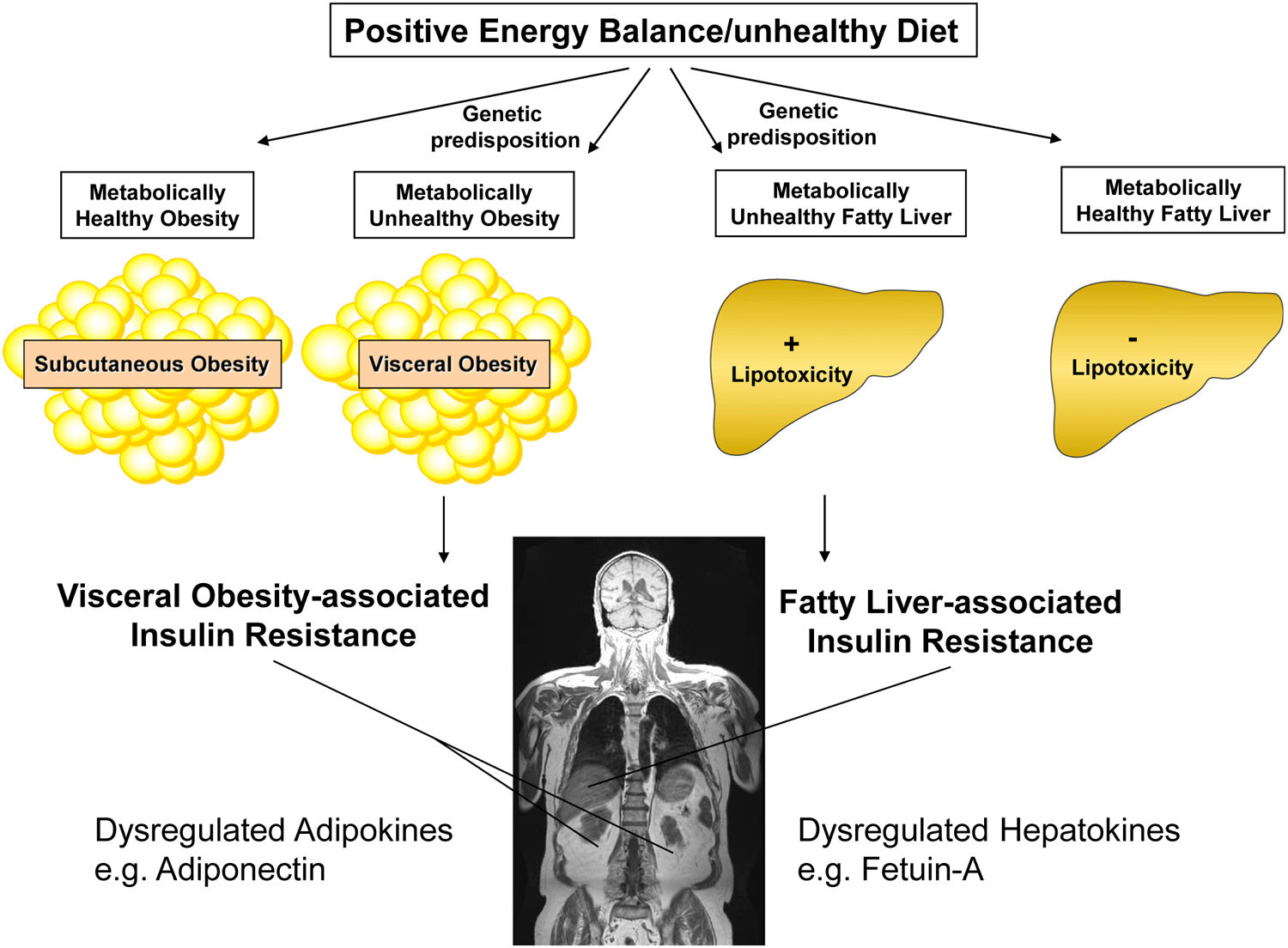
在正能量平衡和不健康饮食的条件下,皮下和内脏脂肪组织的扩张方式主要由基因决定。皮下(代谢健康)肥胖与心血管代谢疾病没有很强的相关性,而内脏肥胖则是这些疾病一个强有力的预测因素。脂肪酸供应增加、亚临床炎症增加、脂肪因子产生和释放失调被认为会促进胰岛素抵抗、动脉粥样硬化和β细胞功能障碍。这一过程的主要特征是脂肪因子的产生和分泌失调。肝脏中脂质的积累也是由遗传决定的,并且已经确定了两种不同的表型。当肝脏排毒过程活跃时,肝脏中脂质的储存与代谢性疾病无关。相反,当存在脂毒性时,肝脏葡萄糖生成增加,脂质释放,具有致动脉粥样硬化的特征。这一过程的主要特征是肝因子产生和分泌失调。
原文链接:https://linkinghub.elsevier.com/retrieve/pii/S1550413123000062
关注微信公众号代谢学人
了解更多代谢前沿资讯

https://blog.sciencenet.cn/blog-3483272-1407505.html
上一篇:Cell Stem Cell:改写衰老宿命,让细胞“青春永驻”
下一篇:代谢学人—— Cell metabolism 综述:单细胞解析脂肪组织可塑性