博文
一种通过改造pET质粒增加大肠杆菌蛋白表达的方法
|||
一种通过改造pET质粒增加大肠杆菌蛋白表达的方法
本文为读后感,原文见文后,读后感作者:朱凯祥
pET系列质粒广泛应用在大肠杆菌中表达重组蛋白。其控制转录和翻译的基因元件自20世纪80年代首次被描述后一直没有改变。在这篇文章中,研究人员发现这些基因元件的设计缺陷并加以改造,通过实验验证,发现改造后质粒的蛋白表达水平得到了显著提升。
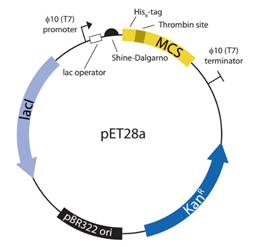 | |||
传统的pET质粒是在pBR322质粒的基础上插入了T7强启动子和T7终止子。文章指出pET28a载体中的T7lac启动子缺乏完整的T7共识序列(T7pCONS)。原本的T7噬菌体中的φ10启动子是由-17到+6的23个核苷酸组成,而pET28仅包含了-17到+2区域,缺失了四个核苷酸。研究人员分别在pET28a上构建了包含这两种启动子序列的表达绿色荧光蛋白sfGFP的载体,通过荧光强度确认了包含完整的共识序列的pET28a+ T7pCONS的蛋白表达水平更高。并且在更换表达菌株或者其他pET系列载体时,结果依然如此。
随后,研究人员又指出传统pET28a的第二个缺陷是它的翻译起始区(TIR)。TIR是一段大约30个核苷酸构成,在翻译起始阶段被30S核糖体亚基识别的序列。有文献报导在天然大肠杆菌中翻译起始区其实会和大肠杆菌的核糖体共进化。因此研究人员采用了一种合成进化的方法来识别pET28a的TIR,使它可能与宿主细胞核糖体更兼容。他们以pET28a为模板去构建了两个TIR文库,通过使用了一个β内酰胺酶共翻译系统去筛选表达量最高的构建。最终得到了两个可提高蛋白表达水平的TIR突变体构建,TIR-1和TIR-2(如下左图)。比较传统的pET28a,改造后的+ T7pCONS,TIR-1和TIR-2表达sfGFP蛋白的能力如下右图所示。
研究人员又通过组合TIR-1+T7pCONS,TIR-2 +T7pCONS,得出sfGFP的表达水平进一步提高。他们又尝试表达了其他两个蛋白MTH1 和 Neil3,与传统的pET28a相比,改造后的质粒的蛋白表达水平均显著提高。蛋白体外纯化实验发现这种改造不影响蛋白的可溶性。
总结:这篇文章的方法学对于提高PET28a载体蛋白产量的效果是显而易见的,对于一些表达量低的蛋白可以尝试使用该改造系统。
原文标题:Improved designs for pET expression plasmids increase protein production yield in Escherichia coli
原文链接:https://www.nature.com/articles/s42003-020-0939-8
https://blog.sciencenet.cn/blog-2484430-1235107.html
上一篇:新冠病毒(COVID-19)RNA依赖的RNA聚合酶的结构
下一篇:不同构建的SARS-Cov Mpro活性比较及其抑制剂评价