编者按:基于生物质谱的蛋白质组技术为精准医学在蛋白质水平的生命过程和生命现象提供了强有力的武器。除了癌症等领域的分子分型和标志物筛选验证以外,蛋白质组学在感染性疾病的研究中也有广泛的应用。
由于病原菌和宿主之间的识别从本质上讲是蛋白质之间的相互作用,因此蛋白质组技术在该领域研究中发挥了重要作用。2018年,蛋白质组学研究病原-宿主互作的论文屡屡见刊于Cell、Nature、Immunity等高水平学术期刊,今天我们回顾这些发生在2018年的亮点研究,去洞察科学家如何运用蛋白质组学研究来探究病原-宿主互作机制。
病原-宿主互作研究
1.Nature:蛋白质组学揭示新型寨卡病毒宿主因子
2.CELL:蛋白相互作用研究揭示三大致命病毒发病机制
3.Immunity:蛋白质组学揭示BIRC5抑制感染HIV-1细胞凋亡的机制
4.Cell Host & Microbe:蛋白质稳定性分析揭示人巨细胞病毒逃逸机制
5.Cell Host & Microbe:过氧化物酶体生物合成是疱疹病毒复制的一种代谢策略
6.Nat. Commun. : 蛋白质乙酰化的动态变化是细胞防御和病毒入侵的关键点
7.J CLIN INVEST: 代谢酶ACSS 2通过组蛋白巴豆酰化修饰调控HIV休眠
8.MCP:蛋白质组学揭示幽门螺杆菌引发胃癌的分子机制
1.Nature:蛋白质组学揭示新型寨卡病毒宿主因子
Pietro S , et al., 2018, An orthogonal proteomic survey uncovers novel Zikavirus host factors. Nature
寨卡病毒(ZIKV)广泛的传播性及可造成新生儿严重神经系统疾病和小头畸形而已成为全球健康问题。然而,ZIKV如何感染脑部星形胶质细胞(Astroglia),以及病毒进入细胞后如何干扰细胞的生理功能仍然了解不多。
2018年9月,德国科学家在著名学术期刊Nature上报道了最新的研究成果: 利用 蛋白质组学、磷酸化修饰组学 分析ZIKV蛋白和寄主细胞的相互作用。
本研究使用整合 蛋白质组学 方法,鉴定与人SK-N-BE2神经母细胞瘤细胞中表达的10种ZIKV蛋白中的每一种相互作用的细胞蛋白和相关复合物,研究鉴定到了386种 ZIKV 相互作用蛋白、ZIKV 特异性和泛黄病毒活性相关的宿主因子,并绘制了神经元细胞中的ZIKV蛋白-宿主蛋白相互作用网络。
此外,研究者还运用 磷酸化修饰组学 分析确定了在 ZIKV 感染后特异性上调或下调的1,216个磷酸化位点,表明病毒感染引起基本信号传导通路如 AKT,MAPK-ERK和ATM-ATR 的深度调节,为 ZIKV 感染引起的增殖停滞提供了新的见解。
研究综合确定了ZIKV宿主依赖因子,并为系统理解 ZIKV 对蛋白质层面和细胞通路层面上的扰动提供了一个全面的框架。
文献精读: “抽丝剥茧”:利用蛋白质组学寻找Zika病毒的寄主因子

神经细胞中的ZIKV蛋白-宿主蛋白相互作用网络
2.CELL:蛋白相互作用研究揭示三大致命病毒发病机制
Jyoti Batra, et al, 2018. Protein Interaction Mapping Identifies RBBP6 as a Negative Regulator of Ebola Virus Replication. Cell.
Priya S. Shah, et al, 2018. Comparative Flavivirus-Host Protein Interaction Mapping Reveals Mechanisms of Dengue and Zika Virus Pathogenesis. Cell.
埃博拉病毒、登革热病毒和寨卡病毒,这三大病毒每年感染数百万人,导致严重疾病、出生缺陷或死亡,并且无药医治。2018年12月,Cell以背靠背形式,发表了针对病毒与宿主相互作用的两项新的研究。研究人员运用系统的蛋白质-蛋白质相互作用策略,阐述了这三种病毒劫持、感染人体细胞的关键途径。
在第一篇论文中,研究人员采用了亲和标记纯化质谱(AP-MS)技术,探查人类蛋白和埃博拉病毒蛋白之间的相互作用,研究共鉴定到194种病毒-人类互作,涉及6种埃博拉病毒。他们不仅发现了埃博拉病毒蛋白VP30和人类蛋白RBBP6之间相互作用的有力证据,还确定了RBBP6与VP30结合的23个氨基酸区域。
在第二篇论文中,研究人员分析比较两种黄病毒(DENV和ZIKV)与两种宿主(人和蚊子)间的病毒-宿主相互作用,探索了蚊子传播引发临床症状的登革热和寨卡病毒。研究发现这2种病毒在2种不同物种的宿主中共享一种相互作用:病毒NS4A蛋白和宿主SEC61蛋白。 作者找寻到了一种 ZIKV 特有的蛋白相互作用——NS4A和ANKLE2 相互作用,并且与之相关的基因被证实与遗传性小头畸形相关。
本研究为药物开发带来了新思路:不再以病原体本身为靶点,而是以病毒“劫持”的人体的蛋白质为靶点进行药物开发。
文献精读:Cell | 蛋白相互作用研究指明三大致命病毒药物靶点
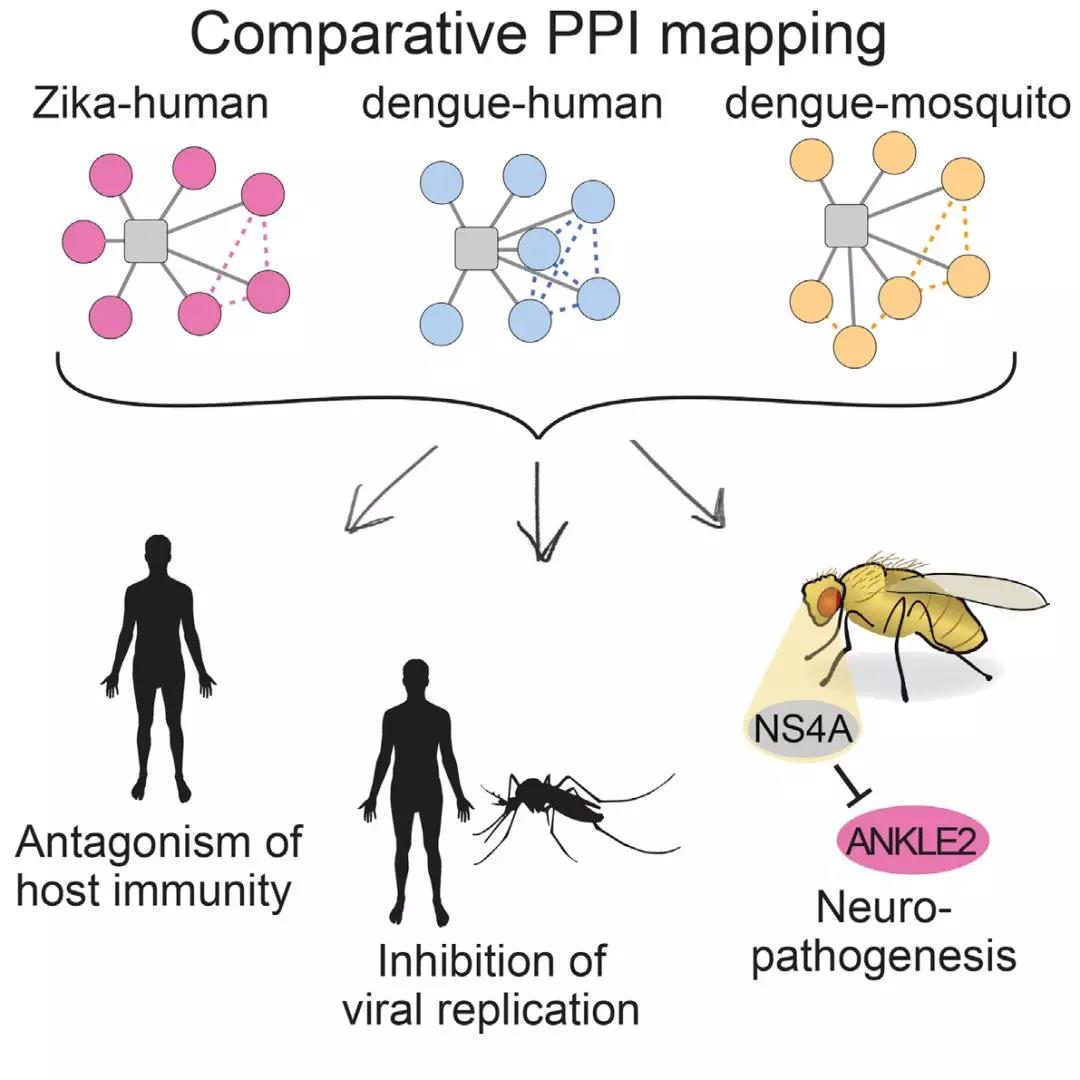
黄病毒-宿主的蛋白相互作用图谱
3.Immunity:蛋白质组学揭示BIRC5抑制感染HIV-1细胞凋亡的机制
Lee G Q, et al., 2018, Anti-apoptotic Protein BIRC5 Maintains Survival of HIV-1-Infected CD4+ T Cells. Immunity.
研究发现部分CD4+T细胞在抗病毒药物治疗下依旧可以存活,导致患者进入慢性感染期。这一现象表明,HIV-1感染细胞后,会激活一些特殊的信号通路,保证细胞免于凋亡而维持其长期存活。
如果所有HIV-1感染的细胞都能被杀死,那么患者会被完全治愈。为了研究HIV-1病毒复制过程中的信号通路变化,研究者运用定量蛋白质组学对宿主 CD4+T细胞作为样本进行分析。共检测到7761个蛋白,其中有552个差异表达蛋白。并进一步 对差异表达蛋白做了功能网络分析,以研究HIV感染后CD4+T细胞存活的调控机制。
该研究发现HIV-1感染激活的细胞存活机制是由凋亡抑制因子BIRC5调控,BIRC5和其上游分子OX40在感染的CD4+T细胞中表达上调,并与T细胞活力维持相关,研究结果为未来治疗HIV-1感染提供了潜在靶点。该研究结果2018年6月发表在国际著名期刊Immunity上。
文献精读: 蛋白组学揭示BIRC5抑制感染HIV-1细胞凋亡的机制

BIRC5调控HIV-1感染细胞凋亡
4.Cell Host & Microbe:蛋白质稳定性分析揭示人巨细胞病毒逃逸机制
Nightingale K, et al., 2018, High-Definition Analysis of HostProtein Stability during Human Cytomegalovirus Infection Reveals AntiviralFactors and Viral Evasion Mechanisms. Cell Host Microbe.
人巨细胞病毒(HCMV)是一种临床上广泛存在的病原体,一旦感染则终身潜伏,当机体免疫力低下时,病毒激活则会导致多种疾病。
HCMV 具有多种免疫逃避策略,包括促进宿主抗病毒限制因子(ARFs)的降解。在 HCMV 感染早期会通过蛋白酶体和溶酶体激活宿主蛋白降解途径,基于此,本研究结合蛋白质组和转录组的方法识别与先天免疫功能相关的关键蛋白,鉴定到35种富集于抗病毒限制因子的蛋白,最后通过一种病毒突变子 panel 预测到靶向250多种人类蛋白的病毒基因。
本研究的方法和数据预示了先天抗病毒免疫分子的重要性,能够进一步识别 HCMV或其他病毒靶向的宿主先天免疫途径。该研究结果2018年8月发表在国际著名期刊Cell Host & Microbe上。
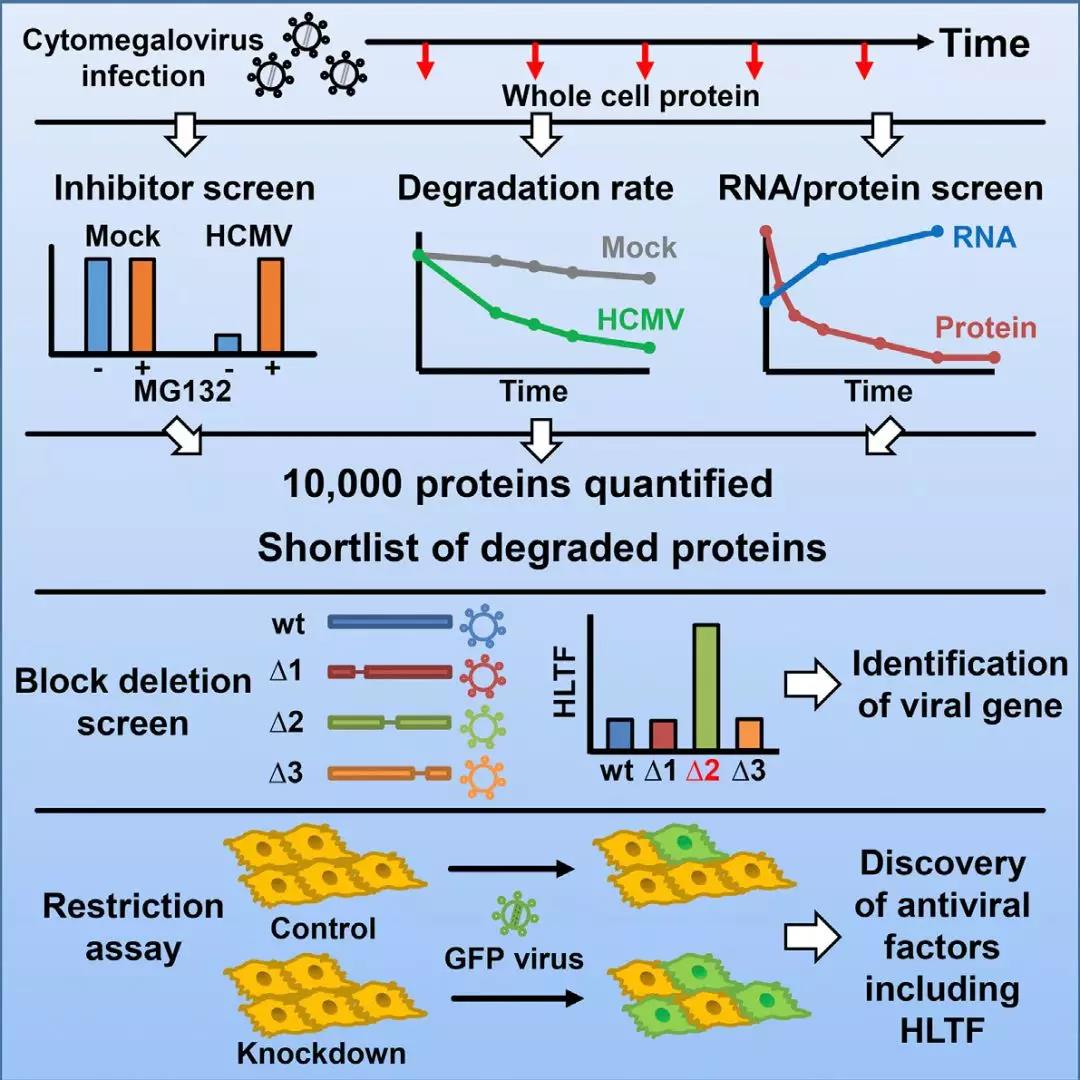
人巨细胞病毒感染期间宿主蛋白质的稳定性分析揭示抗病毒因子和病毒逃逸机制
5.Cell Host & Microbe:过氧化物酶体生物合成是疱疹病毒复制的一种代谢策略
Pierre M. et al.,2018, Infection-Induced Peroxisome Biogenesis Is a Metabolic Strategy for HerpesvirusReplication. Cell Host & Microbe.
过氧化物酶体是一种多功能的细胞器,广泛存在于真核细胞中,在人体中起着重要的作用,过氧化物酶体生物合成异常的患者会出现致命的代谢紊乱和发育缺陷。病毒在感染过程中会靶向宿主的某一细胞器以帮助病毒完成复制、释放和再次感染。过氧化物酶体在脂质代谢中起着重要作用,但在病毒感染中的作用尚不明确。
本研究利用定量蛋白质组、荧光共聚焦和免疫荧光的方法,研究了疱疹病毒(HCMV)和I型单纯疱疹病毒(HSV-1)在感染细胞过程中,过氧化物酶体所发挥的作用。发现感染后期过氧化物酶体数量增加是包膜病毒 HCMV 和 HSV-1 的共同特征,表明过氧化物酶体对HCMV 和HSV-1 病毒的复制是必需的。该研究结果2018年9月发表在国际著名期刊Cell Host & Microbe上。
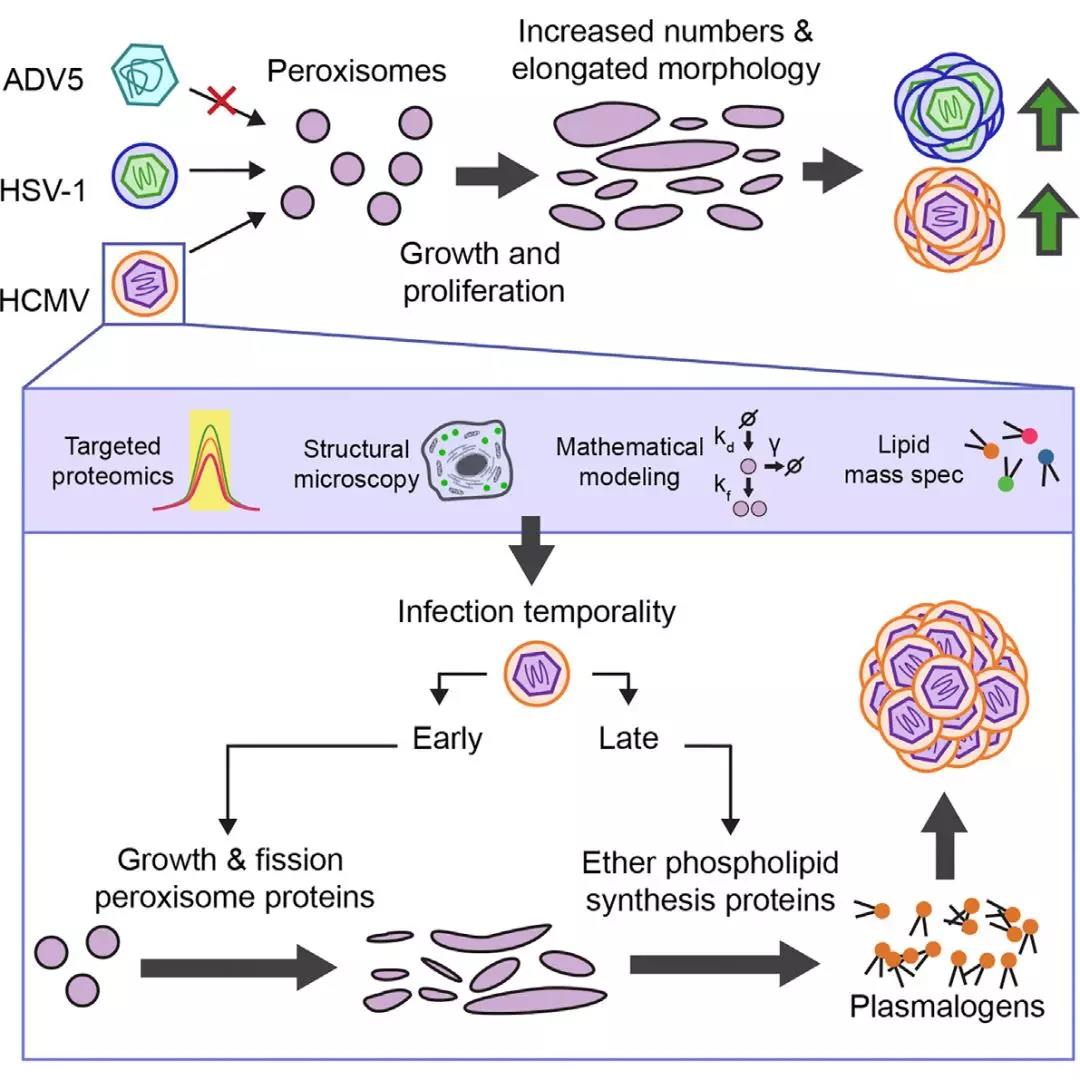
感染诱导的过氧化物酶体生物合成是疱疹病毒复制的一种代谢策略
6. Nat Commun:蛋白质乙酰化的动态变化是细胞防御和病毒入侵的关键点
L. A. Murray, et al., 2018, Orchestration of protein acetylation as a toggle for cellular defense and virus replication. Nature Communications.
乙酰化修饰是一种广泛存在的蛋白质翻译后修饰,主要发生在赖氨酸侧链,在细胞自身抵抗病毒感染或者是病毒实现自身复制的过程中都起到十分重要的作用。但在病毒入侵的过程中,对于蛋白质乙酰化修饰变化研究的依旧为之甚少。
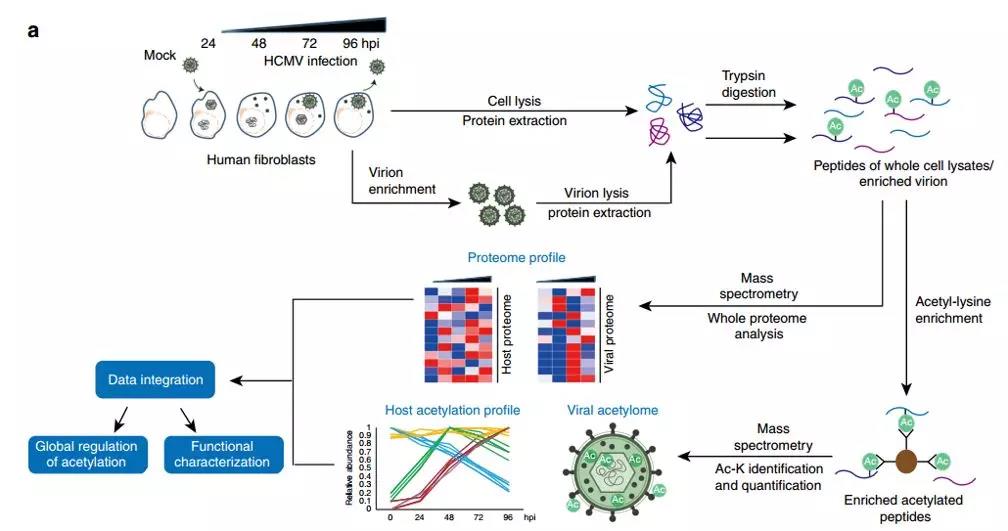
本文于2018年12月发表在Nature Communications上,研究人员以人成纤维细胞(Human fibroblasts) 和 巨细胞病毒(HCMV)病毒为例,通过研究该病毒入侵宿主细胞过程中蛋白含量和乙酰化水平随时间上的变化,并结合蛋白空间定位信息,从而实现从空间和时间、宿主和病毒多重角度揭露乙酰化修饰的变化。
研究共鉴定到6180个乙酰化肽段和2018个对应蛋白质,并确定乙酰化修饰位点。通过使用基于强度的直接定量方法(iBAQ),揭示了HCMV病毒入侵过程中乙酰化修饰空间和时间角度的全方面变化。研究发现K134R突变导致细胞核中病毒衣壳无法穿过细胞核膜。
7.J CLIN INVEST: 代谢酶ACSS 2通过组蛋白巴豆酰化修饰调控HIV休眠
Guochun Jiang, et al., 2018, HIV latency is reversed by ACSS2-driven histone crotonylation. The Journal of Clinical Investigation.
早期的研究发现对组蛋白去乙酰化酶或甲基转移酶的抑制可以激活HIV并促进病毒对抗HIV药物敏感,但是效力相对较低,存在其他潜在未知的表观遗传修饰存在进而影响HIV的激活。
组蛋白巴豆酰化修饰基团与组蛋白乙酰化修饰在结构上具有一定的相似性。2018年3月,国际专业学术期刊The Journal of Clinical Investigation上报道了宿主细胞组蛋白巴豆酰化修饰水平与HIV病毒显现机制之间的关联。
研究者采用巴豆酸钠处理培养的CD4T细胞,发现组蛋白巴豆酰化修饰水平的提高与ACSS2蛋白相关,对ACSS2蛋白的干扰抑制能够有效影响HIV潜伏期;通过巴豆酸钠和已报到的HIV激活药物联合用药,能够大大增加HIV病毒从潜伏期向激活状态转变。研究者通过生化实验最终梳理出ACSS2通过组蛋白巴豆酰化修饰调控HIV的休眠与激活机制。
研究在组蛋白乙酰化修饰的基础上,从表观遗传学角度,进一步发现新型修饰——组蛋白巴豆酰化修饰在HIV休眠与激活的表观遗传调控中扮演的重要角色。同时提出了增加巴豆酰化修饰和传统激活药物的联合用药能够大大提高HIV激活效率,为HIV的研究与治疗指明了方向。
文献精读:代谢酶ACSS 2通过组蛋白巴豆酰化修饰调控HIV休眠,有望成为治疗靶点
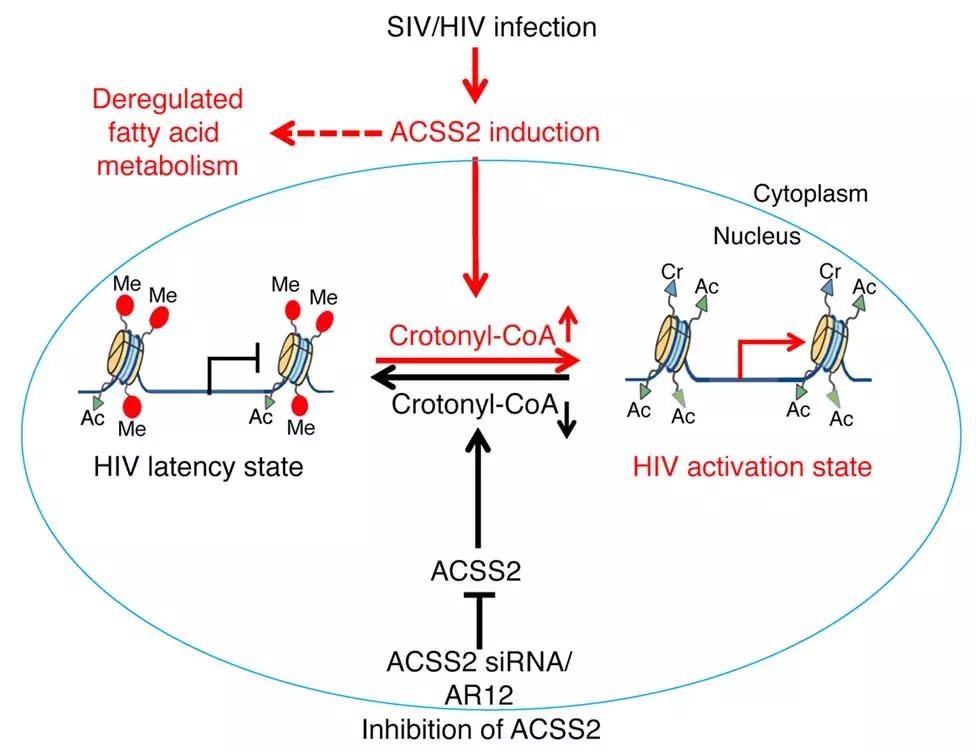
代谢酶ACSS2通过组蛋白巴豆酰化修饰调控HIV休眠
8.MCP:蛋白质组学揭示幽门螺杆菌引发胃癌的分子机制
Jennifer M. Noto, et al. (2018), Carcinogenic Helicobacter pylori strains selectively dysregulate the in vivo gastric proteome, which may be associated with stomach cancer progression. Molecular & Cellular Proteomics.
胃癌在全球癌症相关死亡的排名中高居第三名,每年死亡人数超过720,000。胃癌已知最强致病因素是由微生物病原体幽门螺杆菌(Helicobacter pylori)诱导的慢性胃炎。全世界有超过50%的人感染幽门螺杆菌,但是只有一部分感染个体发展成癌症。
近日,蛋白质组学领域Top期刊Molecular & Cellular Proteomics报道运用蛋白质组学研究致癌性幽门螺杆菌引发胃癌的机制研究。研究者运用定量蛋白质组学对没有感染和感染了cag+阳性幽门螺杆菌的沙鼠病变前的胃部组织进行检测,去探究幽门螺杆菌引发胃癌过程级联反应的变化。
研究运用运用iTRAQ标记定量蛋白质组学对没有感染和感染幽门螺杆菌沙鼠的胃组织细胞进行分析,共鉴定到2764个蛋白,有166个蛋白发生显著改变,其中炎症和肿瘤相关信号通路如Rab/Ras蛋白变化明显。
组学实验、生信分析和后续的验证实验表明,体内体外不同的实验条件下,RABEP2和G3BP2这两个与炎症和癌症密切相关的蛋白在幽门螺杆菌感染的胃细胞中发生显著上调并参与胃癌进程。
全文不仅清楚的解析了幽门螺杆菌引发胃癌的具体机制,更为后续临床上胃癌的早期诊断和治疗提供指导意义。
文献精读:幽门螺杆菌如何引发胃癌?蛋白质组学揭晓其中机制
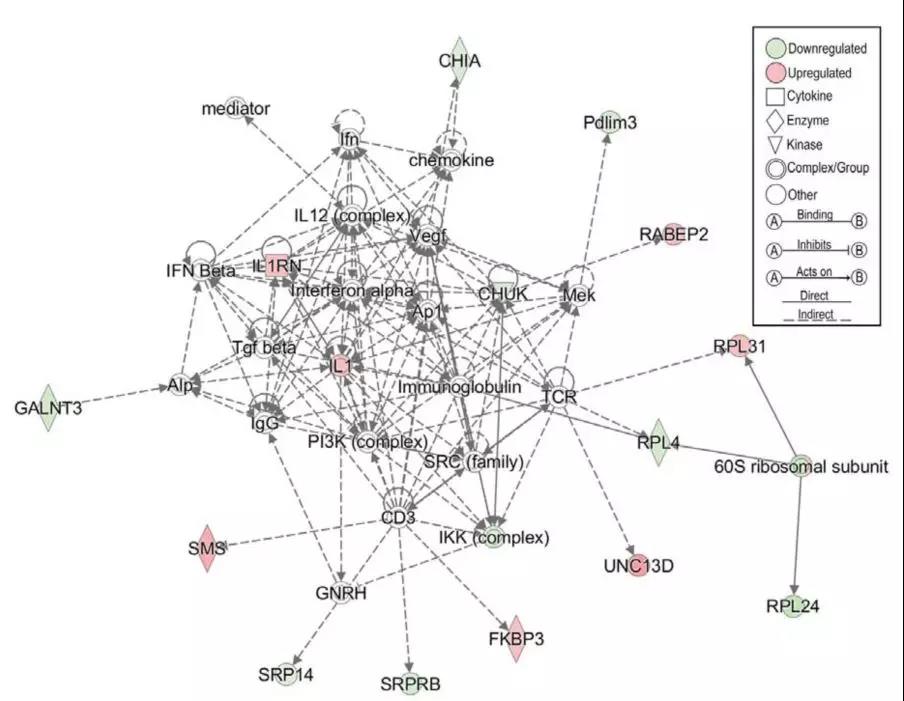
幽门螺杆菌感染引发显著改变的蛋白网络
综上所述,我们可以看出,蛋白质组学技术在病原-宿主互作的研究运用主要有:
1、发现新的互作蛋白复合体;
2、解析病毒侵染前后宿主和病原体蛋白的表达和翻译后修饰变化;
3、解析侵染过程中的蛋白质动态时空分布变化。
蛋白质作为生命活动的“执行者”,运用蛋白质组学、蛋白质修饰组学技术,能够直接分析疾病发生发展的过程中对蛋白质表达变化,从而更深入地理解病原菌和宿主之间的相互作用过程 。
本文来自病毒学界,景杰生物学术团队补充编辑,欢迎转发到朋友圈。如有转载、投稿、等其他合作需求,请添加微信ptm-market或致电400-100-1145咨询。