博文
Cell Chem Biol | 蛋白组及磷酸化修饰组揭示IRAK4在淋巴瘤细胞增殖和炎症中的调控作用
||
发布时间:2020年9月3日
题目:Assessing IRAK4 Functions in ABC DLBCL by IRAK4 Kinase Inhibition and Protein Degradation(通过IRAK4激酶抑制和蛋白质降解评估弥漫大B细胞淋巴瘤中的IRAK4功能)
期刊:Cell Chemical Biology
影响因子:7.739
作者及单位:强生集团杨森制药研发中心研究团队
主要结论:IRAK4只部分参与弥漫大B细胞淋巴瘤 (ABC DLBCL) 细胞增殖及炎症信号的调控作用。
白细胞介素-1受体相关激酶 (interleukin-1 receptor associated kinases, IRAKs) 是一种重要的丝/苏氨酸 (Ser/Thr) 蛋白激酶,主要包括IRAK1、IRAK2、IRAKM和IRAK4。在机体炎症反应、免疫应答信号转导过程中,IRAK4可发挥支架作用,与髓样分化因子MyD88形成寡聚复合物Myddosome,使得IRAK4发生自身磷酸化激活其他IRAKs激酶活性,继而激活NF-κB (nuclear factor kappa-B) 及MAPK (mitogen-activated protein kinase) 信号通路,最终促进IL-6等多种促炎细胞因子的转录和表达,参与调控肿瘤的发生发展、侵袭及转移。
有报道指出,许多强效IRAK4抑制剂在较低浓度时 (纳摩尔级) 就能有效地抑制IRAK4活性以及炎性因子的释放,但却只有在高浓度 (微摩尔级) 时,才能抑制弥漫大B细胞淋巴瘤 (active B-cell-like diffuse large B cell lymphoma, ABC DLBCL) 细胞增殖。这些结果引出一种假设,即在ABC DLBCL中,IRAK4能通过其自身支架蛋白功能影响Myddosome的组装,调控NF-κB、MAPK信号通路,这一过程可能并不依赖于IRAK4自身酶活性。基于此,众多生物医药企业一直在尝试开发高效的IRAK4靶向抑制剂,这不仅有助于IRAK4调控肿瘤细胞功能的分子机制揭示,也有助于治疗ABC DLBCL新型药物的开发。
2020年9月3日,来自强生(集团)杨森制药中国、美国、比利时的研究人员,在国际专业学术期刊Cell Chemical Biology (IF = 7.739) 上发表了题为“Assessing IRAK4 Functions in ABC DLBCL by IRAK4 Kinase Inhibition and Protein Degradation”的研究论文。研究人员利用蛋白水解靶向嵌合体PROTAC (proteolysis-targeting chimers) 技术设计了多种IRAK4靶向降解剂,并在ABC DLBCL细胞系中,调查了这些新型IRAK4降解剂和传统IRAK4酶活抑制剂,对IRAK4下游关键炎症信号蛋白质磷酸化水平的变化及肿瘤细胞功能的影响。景杰生物为该研究的蛋白质组学与磷酸化修饰组学定量提供技术支持。

研究速读
该研究首先通过高通量药物筛选,发现了一种IRAK4高效选择性抑制剂——Compound 1,其对IRAK4的半数抑制浓度IC50为3 nM (图1A)。在正常单核细胞系THP-1中,Compound 1不仅可以显著抑制NF-κB、MAPK信号通路关键蛋白质IKKα/β、 IκBα、JNK和p38磷酸化水平 (图1C),还可以显著减少THP-1在脂多糖 (lipopolysaccharide, LPS) 刺激时释放IL-6的含量 (图1D)。然而,在三种MyD88突变驱动产生的ABC DLBCL细胞系中(包括具有MyD88 L265P的HBL-1、OCI-LY3,以及具有MyD88 S222R的SU-DHL-2)中,Compound 1仅对HBL-1细胞p38磷酸化水平产生较为明显的抑制 (图1E),并且对三种细胞系的凋亡、增殖过程均无明显影响 (图1F, G)。以上结果表明,单纯地通过Compound 1抑制IRAK4酶活性,无法抑制ABC DLBCL炎症信号通路及细胞增殖。
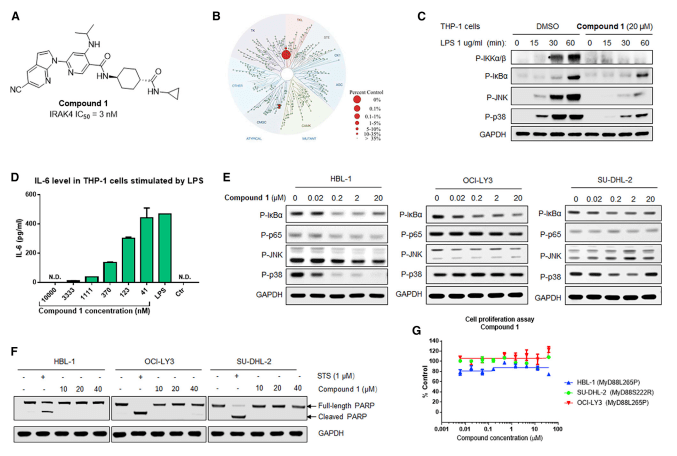 图1 Compound 1对THP-1及ADC DLBCL细胞功能的影响
图1 Compound 1对THP-1及ADC DLBCL细胞功能的影响
接下来,研究人员采用了一种蛋白质降解策略,通过PROTAC将IRAK4募集到E3泛素连接酶进行泛素化标记,经由细胞自身的泛素-蛋白酶体系统 (ubiquitin-proteasome system, UPS) 降解IRAK4,以实现更有效的IRAK4支架功能抑制作用。利用这一策略,作者们设计了多种新型PROTAC分子 (Degrader-1, …, Degrader-8)。它们一端含有Compound 1,可特异性结合IRAK4并抑制其激酶活性;另一端,则接有沙利度胺 (thalidomide) 以结合E3连接酶cereblon (CRBN) ,两端之间再由不同结构的linker连接起来 (图2A)。这些IRAK4靶向降解剂具有非常好的降解效价强度 (DC50<1 μM) 以及效能 (Dmax>90%)。值得注意的是,蛋白质定量组学结果显示,在OCI-LY3鉴定到的9,741种蛋白质中,Degrader-5只特异性降解IRAK4 (图2B)。
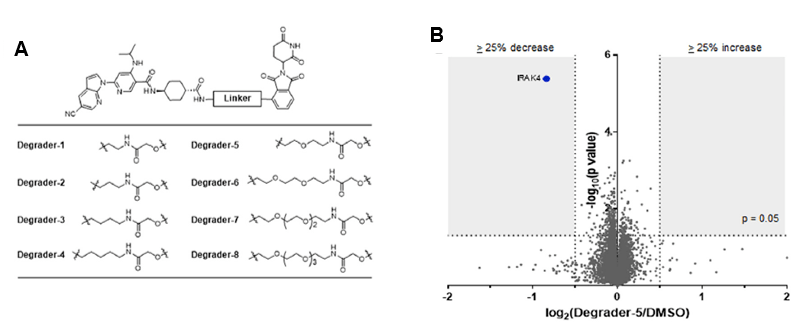 图2 IRAK4蛋白水解靶向嵌合体
图2 IRAK4蛋白水解靶向嵌合体
随后,研究人员选择Degrader-3和Degrader-5作为具体的研究对象。结果显示,它们虽然可以非常有效地降解HBL-1细胞系中的IRAK4 (图3A),但是对炎症信号通路中关键蛋白质磷酸化水平的抑制作用却仍然有限 (图3A),这意味着IRAK4只部分参与ABC DLBCL中炎症信号的调控。有意思的是,Degrader-3和Degrader-5也并未对ABC DLBCL细胞系的凋亡、增殖过程产生明显抑制功能 (图3B, C),表明ABC DLBCL细胞存活并不依赖IRAK4功能。
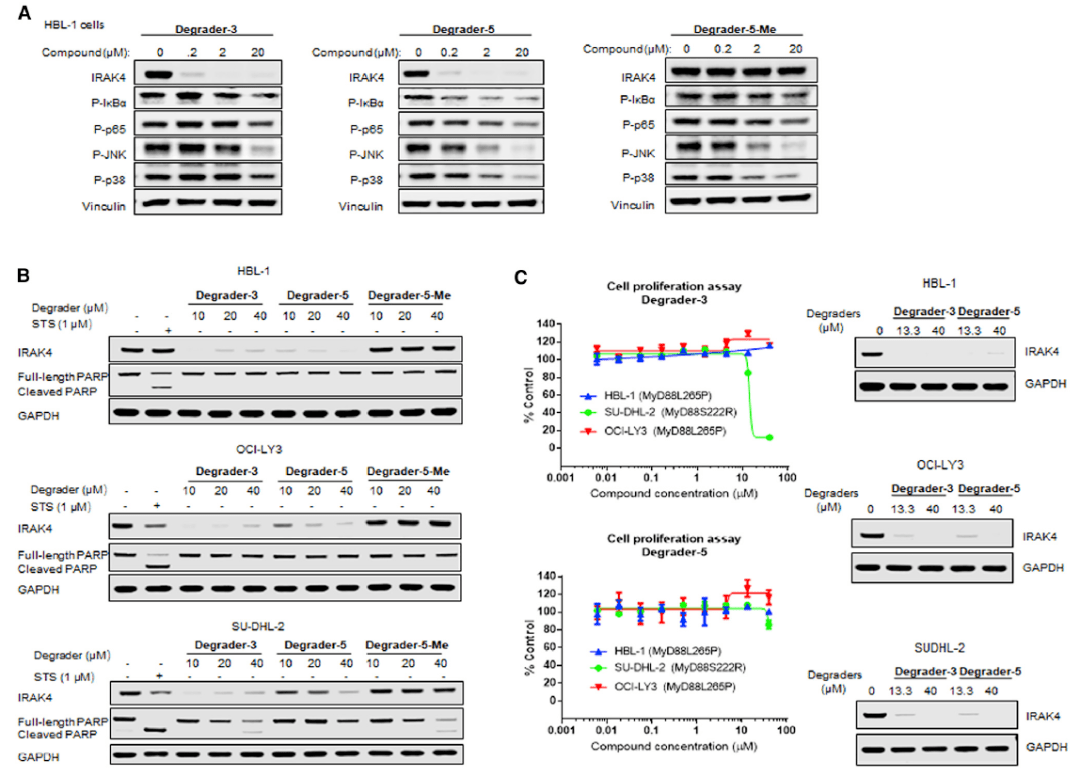 图3 IRAK4靶向降解剂对ADC DLBCL细胞功能的影响
图3 IRAK4靶向降解剂对ADC DLBCL细胞功能的影响
总 结
总之,本研究通过一系列IRAK4特异性抑制剂、靶向降解剂,调查了IRAK4功能受损后对下游信号蛋白质磷酸化修饰水平的影响,并揭示了IRAK4在ABC DLBCL细胞增殖调控过程中的非必需作用,从而为开发针对其他靶点的ABC DLBCL治疗药物提供了重要的研究思路与理论基础。
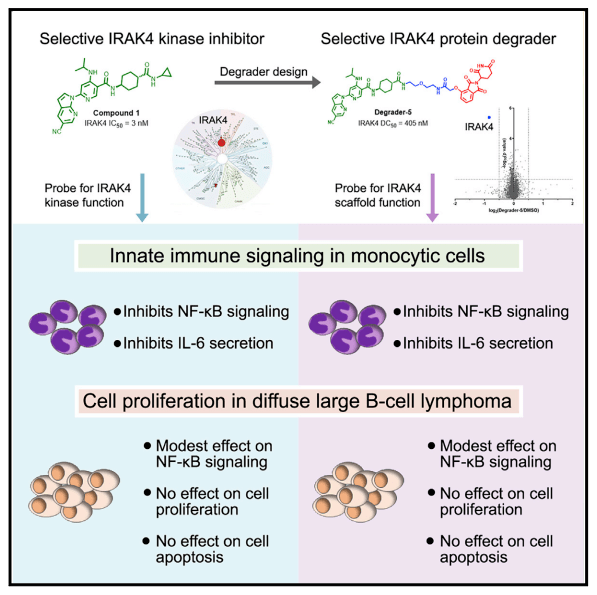 图4 IRAK4活性抑制剂及靶向降解剂对细胞功能的影响
图4 IRAK4活性抑制剂及靶向降解剂对细胞功能的影响
本研究中的蛋白质组学与磷酸化修饰组学定量技术由景杰生物提供技术支持,感谢强生集团杨森制药研发中心团队的信任与支持!
磷酸化修饰(phosphorylation)发生在细胞内超过30%的蛋白质上,是调节和控制蛋白质活力和功能的最基本、最普遍、也是最重要的机制。磷酸化参与各种生理和病理过程,调控细胞的增殖、发育、分化、凋亡等生命活动,广泛运用在信号通路转导、细胞凋亡、发育分化、癌症机理等研究领域。
参考文献:
Jing Zhang, et al., 2020. Assessing IRAK4 functions in ABC DLBCL by IRAK4 kinase inhibition and protein degradation. Cell Chemical Biology.
本文由景杰学术团队报道,欢迎转发到朋友圈。如有转载、投稿、等其他合作需求,请文章下方留言,或添加微信ptm-market咨询。
https://blog.sciencenet.cn/blog-3404471-1251498.html
上一篇:Molecular Cell:浙大基础医学院王迪组揭示HDAC3介导线粒体驱动的IL-1β依赖性炎症机制
下一篇:特别策划|MCP封面故事(2020.04-06),讲述蛋白组及修饰组的“super power”