博文
文献阅读大赛02| 病原体侵染之“秘密武器”:正交翻译后修饰介导的细菌毒力
||
撰稿人:杨玉兰(内蒙古医科大学附属人民医院)
精读文献标题:Bacterial virulence mediated by orthogonal post-translational modification(正交翻译后修饰介导的细菌毒力)
发表时间:2020年9月17日
发表期刊:Nature Chemical Biology
影响因子:12.587
作者及单位:美国塔夫斯大学化学系的Kaitlin A. Chambers和Rebecca A. Scheck
主要结论:总结了与人类感染相关的8种已知的正交翻译后修饰(oPTMs)的现有知识,并进一步强调oPTMs的已知细胞靶标及其生物学作用。
文献精读
在细菌感染期间,宿主细胞可以识别来自入侵细菌的细胞外刺激,通过激活自身的炎症信号来发挥细胞保护作用。为了对抗这些防御机制,细菌进化出了复杂的分泌系统。许多细菌病原体可以直接向宿主细胞分泌毒力因子,即效应子,这些效应子会抑制炎症信号,从而沉默宿主的先天免疫反应,同时也促进细菌的入侵、存活和复制。效应子的一类特殊子集可以利用哺乳动物蛋白质组中没有的化学物质对宿主蛋白质进行翻译后修饰(PTM),这种修饰被称为“正交翻译后修饰”(oPTM)。
2020年9月17日,美国塔夫斯大学化学系的两位学者在国际著名期刊Nature Chemical Biology(IF=12.587)上在线发表了题为“Bacterial virulence mediated by orthogonal post-translational modification”的综述[1]。这篇综述总结了与人类感染相关的8种已知oPTMs的现有知识,并进一步强调了oPTMs的已知细胞靶标及其生物学作用。
一、oPTMs的例子
—— 01 丝氨酸/苏氨酸乙酰化 ——
哺乳动物乙酰转移酶修饰赖氨酸残基、蛋白质N-末端或其他细胞胺,这些胺的乙酰化去除了正电荷,从而改变了对“读者”蛋白质的识别很重要的静电蛋白质表面。细菌会利用丝氨酸/苏氨酸乙酰化来阻断依赖磷酸化的宿主细胞信号。例如,丝氨酸/苏氨酸乙酰转移酶家族的效应子可以催化乙酰辅酶A上的乙酰转移到丝氨酸和苏氨酸残基的羟基上。丝氨酸/苏氨酸乙酰转移酶家族很小,主要由植物病原体的效应子组成。其中,有三个成员属于人类病原体,即鼠疫病原体耶尔森菌分泌的YopJ、胃肠道鼠伤寒沙门氏菌分泌的AvrA和副溶血弧菌分泌的VopA。这三种效应子都可以使MAPK途径(免疫信号的中枢)中蛋白质的丝氨酸(Ser)和苏氨酸(Thr)残基发生乙酰化。
—— 02 磷酸盐β-消除 ——
典型的磷酸化包括蛋白激酶把ATP或GTP γ位的磷酸基转移到丝氨酸、苏氨酸和酪氨酸(Tyr)上羟基的过程。磷酸化很容易被蛋白磷酸酶介导的去磷酸化反应逆转,而再生出未修饰的羟基。然而,细菌磷酸苏氨酸裂解酶或磷酸裂解酶会催化磷酸苏氨酸(pThr)中的磷酸发生β-消除,导致脱氢丁酸的形成,影响磷酸化和去磷酸化修饰过程,进而影响细胞信号转导。参与人类发病机制的该家族成员包括鼠伤寒沙门氏菌的SpvC、福氏链球菌的OspF和紫色色杆菌的VirA。
—— 03 磷酸核糖连接的泛素化 ——
经典的泛素化修饰需要通过E1-E2-E3三酶级联反应来催化完成,而有研究报道,嗜肺军团菌肺炎的病原体嗜肺军团菌分泌的SidE家族效应子却可以通过不依赖E1-E2-E3的全新方式催化宿主蛋白的泛素化修饰。SidE或Sde家族蛋白(SdA、SdB、SdeC和SidE)由IVB型分泌系统分泌,可以模仿宿主泛素化过程,催化泛素精氨酸(Arg)与底物羟基直接连接。该反应是连续的,首先从ADP-核糖与泛素的连接开始,然后是AMP的水解和磷酸核糖化的泛素与底物羟基的连接。
—— 04 谷氨酰胺脱酰胺 ——
蛋白质脱酰胺是一种非酶PTM,通常限于天冬酰胺(Asn)。谷氨酰胺(Gln)残基在正常生理条件下难以进行非酶脱酰胺。Gln脱酰胺作用也是一种oPTM,可以产生羧酸并释放氨,这种oPTM是由Gln通过酰胺水解转化为谷氨酸(Glu)的酶的转化作用导致的。
与其他oPTMs相比,谷氨酰胺的脱酰胺作用是由数量最多的人类病原体催化的。与讨论的其他oPTMs不同,这种修饰仅导致1 Da的小质量变化。如果脱酰胺作用的发生小到无法用化学计量评价,那么很难通过质谱检测得到。
—— 05 磷酸胆碱化 ——
磷酸胆碱向蛋白羟基的酶促加成反应由磷酸胆碱转移酶催化,而细菌可以通过添加磷酸胆碱基团这种前所未有的蛋白质修饰来掩盖干扰宿主细胞信号的关键结合作用。迄今为止,已知只有一种效应子能催化这种转化,即嗜肺军团菌分泌的AnkX。AnkX含有一个保守的Fic结构域,与促进AMPylation的蛋白质同源。
—— 06 其他的oPTMS ——
另几个其他例子表明,oPTMs可将已知的PTMs用于修饰人类细胞中原本不是底物的残基。如肠致病性和肠出血性大肠杆菌(EPEC/EHEC)的NleE效应子和福氏志贺菌的OspZ效应子催化半胱氨酸而非精氨酸或赖氨酸的S-腺苷-L-甲硫氨酸依赖性甲基化。类似地,大肠杆菌的NleB和鼠伤寒沙门菌的SseK1/3在精氨酸上催化N-乙酰氨基葡萄糖酰化(GlcNAcylation)[2,3],与哺乳动物蛋白质常见的O-连接的GlcNAcylation相反。最后,鼠伤寒沙门菌的SopF对谷氨酰胺上的而不是精氨酸上的ADP-核糖基化进行催化[4]。
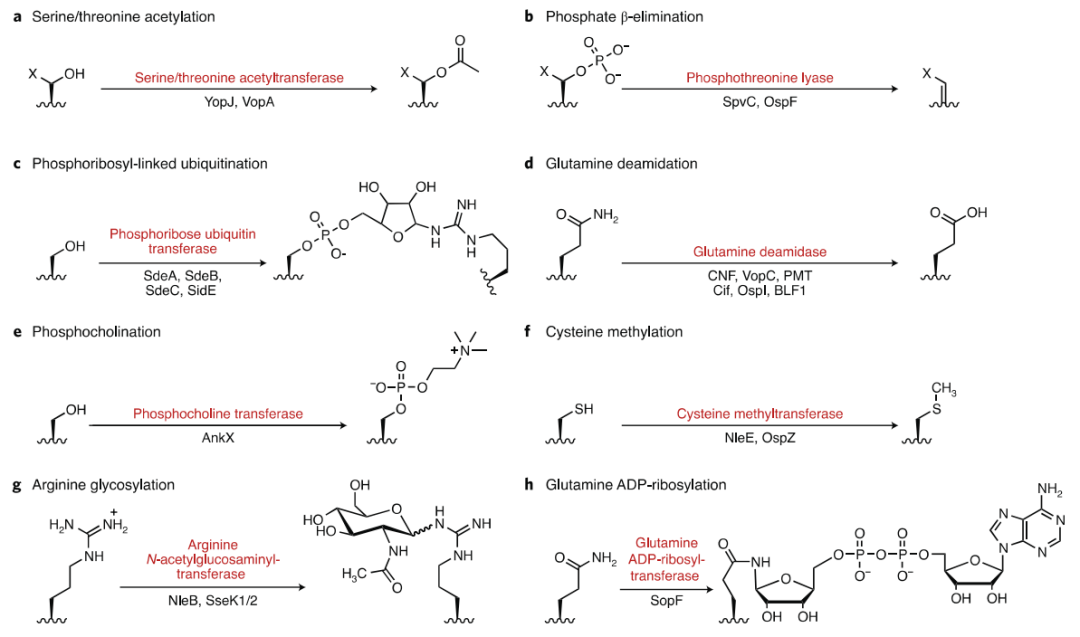 图1 oPTMs的例子
图1 oPTMs的例子
二、oPTMs的生物学作用及意义
—— 01 oPTMs作为候选生物标志物 ——
因为oPTMs不存在于健康组织中,所以它们有望成为判断有无细菌感染的生物标志物。许多分泌oPTM效应子的细菌会导致严重的感染,并很容易通过空气、水和食物来源传播。受感染的个体在感染的早期阶段可能没有症状并且难以诊断,这使得早期检测对于快速治疗和控制至关重要。oPTM效应子在感染的早期阶段被大量消耗,并且它们的产物不断扩增。因此,开发oPTM检测工具可能是一种很有意义的诊断策略。此外,假支原体、志贺氏菌、沙门氏菌和耶尔森氏菌等这些病原体几乎都以独特的组合催化多种oPTMs,这表明oPTMs的离散组还可以诊断特定病原体的感染(表1)。
—— 02 利用oPTMs独特的化学性质 ——
oPTMs的另一个有利方面是它们的反应是独特的,酶催化的,并且在哺乳动物的生化过程中通常是不存在的。因此,催化oPTMs的效应子可以正交修饰细胞系统。此外,催化oPTMs的酶也可以用于生物结合,为选择性标记蛋白质提供新方法。例如,一种遗传编码的AnkX识别基序能够在体外用磷酸胆碱类似物进行位点特异性蛋白质标记。
—— 03 靶向oPTMs对抗细菌感染 ——
细菌对抗生素疗法表现出的耐药性,仍然对全球健康造成了持续威胁。尽管oPTM效应子还未被充分认识,但针对III型分泌系统效应子而非菌株分泌系统本身的靶向性的抗菌策略也被进行了探索。阻断oPTM效应子的活动可能是一种特别有效的抗菌策略。首先,oPTM效应物的基因敲除或催化损伤通常会导致致病性降低。此外,oPTM效应子催化健康人体蛋白质组中缺乏的化学物质,这表明有效的抑制剂可能是特异性的,并且没有非靶效应。最后,oPTM效应子在人体细胞中起作用,可以避免发生由于细菌吸收和小分子药物外流导致的耐药。
三、AMPylator
AMPylation是直到近年来才被认为是正交的一种PTM。一些研究表明,AMPylator在人体细胞中被广泛利用,特别是假激酶,约占人体内所有激酶的10%。通过将假激酶硒蛋白-O(SelO)鉴定为AMPylator,表明人体内的AMPylation有可能比以前认为的更为普遍。
综上,得益于基因组学和蛋白质组学技术的不断发展,在过去的10-15年里,几乎所有的oPTMs都被识别了出来,这表明更多的效应子和整个oPTMs将继续被发现。本篇文章除总结了与人类感染相关的8种已知oPTMs的现有知识并进一步强调了oPTMs的已知细胞靶标及其生物学作用以外,还讨论了近年来才被认为是正交翻译后修饰的AMPylation,试图阐明感染过程中的关键步骤,为确定治疗干预的时机以及人体感染病原体的标志物的发现提供理论基础。
参考文献:
[1] Chambers K.A., Scheck R.A., 2020. Bacterial virulence mediated by orthogonal post-translational modification. Nat Chem Biol.
[2] Ding JJ, et al., 2019. Structural and functional insights into host death domains inactivation by the bacterial arginine GlcNAcyltransferase effector. Mol Cell.
[3] Newson J.P.M., et al., 2019. Salmonella effectors SseK1 and SseK3 target death domain proteins in the TNF and TRAIL signaling pathways. Mol Cell Proteomics.
[4] Xu Y., et al., 2019. A bacterial effector reveals the V-ATPase-ATG16L1 axis that initiates xenophagy.Cell.
本文由景杰学术团队报道,欢迎转发到朋友圈。如有转载、投稿、等其他合作需求,请文章下方留言,或添加微信ptm-market咨询。
https://blog.sciencenet.cn/blog-3404471-1255060.html
上一篇:2020文献阅读大赛 | 植物如何抵抗病原菌侵染?Autophagy:拟南芥通过细胞自噬增强抗性
下一篇:PTM表观遗传修饰“黑马”之巴豆酰化