博文
Nature Cancer | 宋尔卫/苏士成团队揭示lncRNA调控巨噬细胞“双刃剑”作用新机制
|
巨噬细胞 (macrophage, Mϕ) 是先天免疫系统中重要的免疫细胞,也是血液、淋巴和所有哺乳动物组织类型中最常见的吞噬细胞,具有极强的功能多样性。其中,肿瘤微环境组织中存在的巨噬细胞也被称作肿瘤相关巨噬细胞 (tumor-associated macrophages, TAMs)。一般来说,在不同生理病理因素刺激下,巨噬细胞可分化成两种极化状态,即经典活化的M1型和替代活化的M2型。其中,M1型参与促炎反应,同时也发挥抗肿瘤活性,而M2型则参与抗炎反应,并能通过肿瘤免疫抑制等作用促进肿瘤发展。巨噬细胞这种“双刃剑”式的调控功能也在某种刺激下变得更为复杂:比如,肿瘤围手术期化疗诱导IFNs (interferons, IFNs) 效应增强可以促进肿瘤免疫;然而另一方面,也有研究显示,IFNs激活促炎性M1型巨噬细胞后会导致炎性细胞因子IL-1β、IL-1的释放,继而促进肿瘤细胞增殖。巨噬细胞这种看似“矛盾”的生物学功能是如何最终决定化疗疗效的,及其潜在的分子调控机制目前仍是未知。
长链非编码RNA (long-non coding RNAs, lncRNA) 是哺乳动物细胞中最丰富的非编码转录本,已有研究表明,lncRNAs可以通过表观遗传调控作用调节促炎、抑炎相关基因表达或关键蛋白质的翻译后修饰状态,进而影响免疫细胞功能。近日,中山大学孙逸仙纪念医院宋尔卫院士、苏士成教授研究团队在Nature Cancer杂志发表的题为“The IRENA lncRNA converts Chemotherapy-polarized tumor-suppressing Macrophages to Tumor-promoting Phenotypes in Breast Cancer”【1】研究工作表明,lncRNA IRENA (IFN-responsive nuclear factor-κB activator) 是化疗后TAMs促瘤、抗瘤功能转换的关键调控分子,并系统阐明了IRENA激活TAMs NF-κB信号通路是导致化疗后肿瘤出现治疗抵抗的根本性原因。景杰生物为该研究提供了蛋白质组学技术支持及相关生物信息学分析。

一、化疗诱导巨噬细胞出现“双刃剑”样功能
研究人员首先发现,乳腺癌经围手术期化疗后,CD68+ CD163+ 巨噬细胞数量与肿瘤免疫细胞CD8+ CTLs (cytotoxic T lymphocytes) 呈明显正相关,尤其在出现治疗抵抗的乳腺癌组织微环境中CD68+ CD163+ 巨噬细胞更是明显增多,但是这类患者预后却较差。随后,将化疗后乳腺癌组织中分离出的巨噬细胞,分别与乳腺癌细胞系 (MCF-7, SKBR3, MDA-MB-231) 和CD8+ CTLs共同培养,研究人员也发现:1、肿瘤细胞系出现治疗抵抗现象;2、CD8+ CTLs趋化功能增强、穿孔素/颗粒酶B表达增加。以上结果表明,化疗刺激产生的巨噬细胞出现“双刃剑”作用,即一方面促进了肿瘤细胞的治疗抵抗性,但另一方面也增强了肿瘤免疫功能。
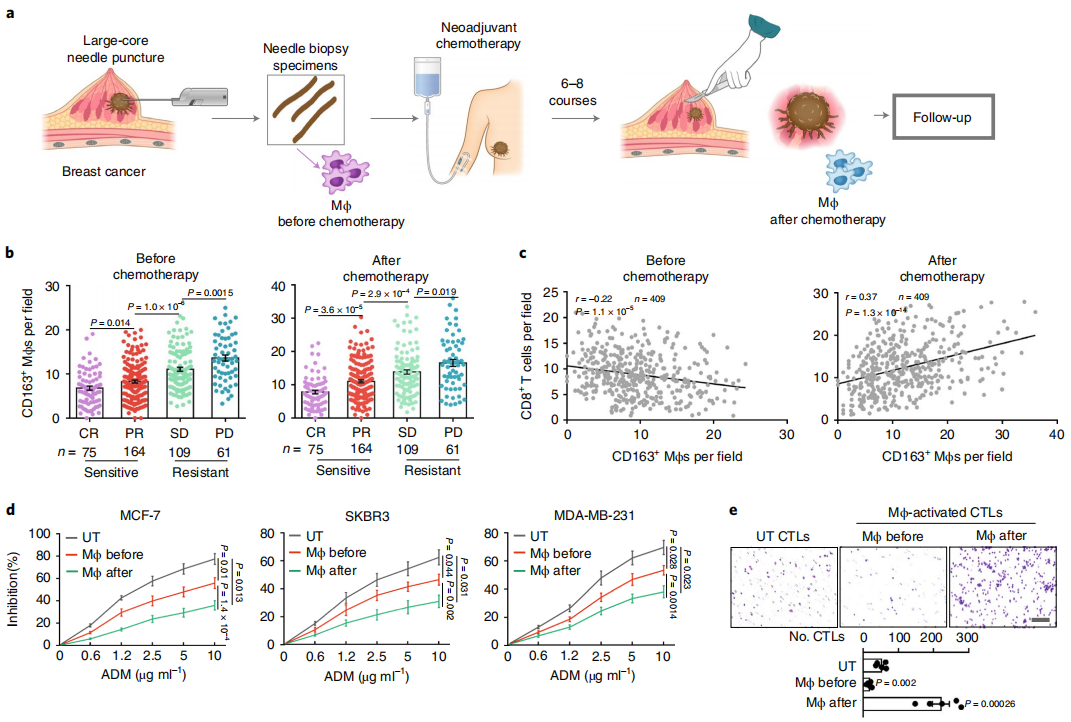
图1 乳腺癌患者化疗后TAMs功能分析
二、蛋白质组学揭示巨噬细胞信号通路功能变化
利用蛋白质组学对化疗前后乳腺癌患者TAMs进行蛋白质功能分析,结果表明,化疗激活了巨噬细胞 Ⅰ 型IFN与炎症相关信号,其中,JAK1-STAT1 (IL-15, CXCL9, CXCL10)、NF-κB (IL-6, IL-8, TNF-α) 信号通路功能及相关细胞因子激活最显著。值得注意的是,当利用特异性抗体中和NF-κB细胞因子后,巨噬细胞引起的肿瘤治疗抵抗效应明显减弱;而JAK1-STAT1信号相关细胞因子被抗体中和后,巨噬细胞引起的肿瘤免疫功能则被明显抑制,揭示了化疗诱导巨噬细胞出现“双刃剑”样功能的潜在分子调控机制。
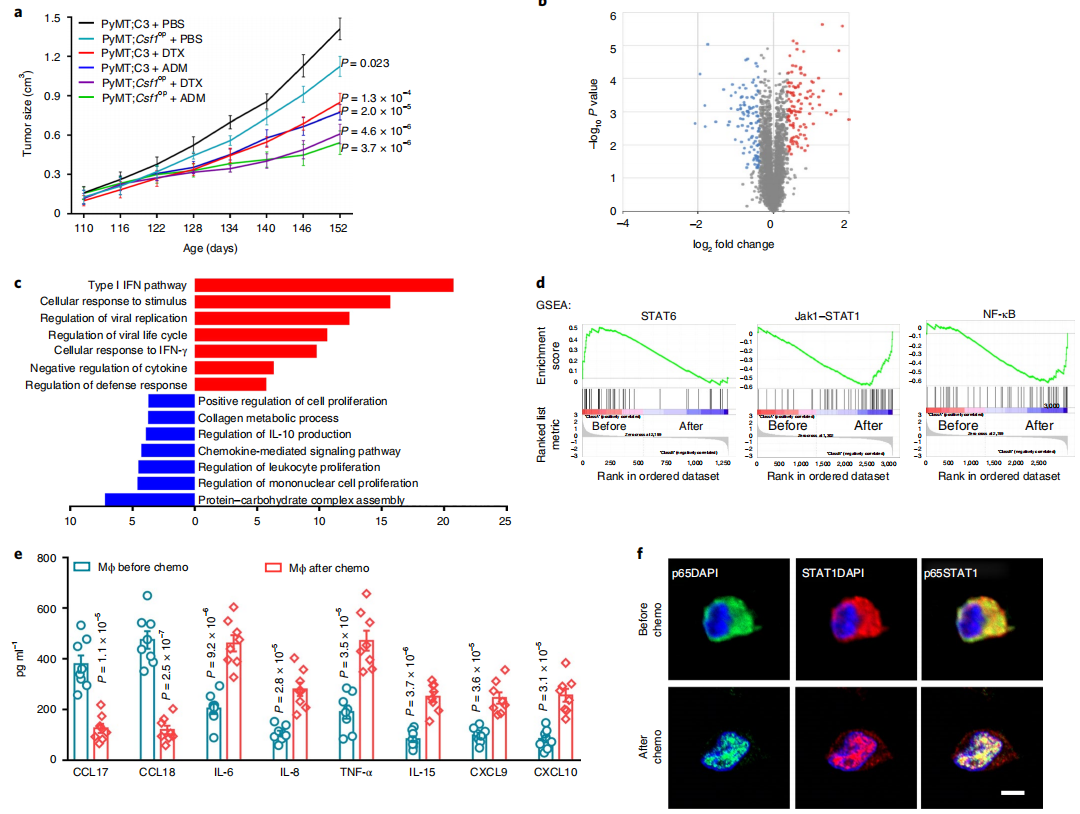
图2 化疗刺激后TAMs蛋白质组的改变
三、巨噬细胞IRENA是调控肿瘤化疗效果的关键分子
有意思的是,研究人员也通过lncRNA芯片发现,乳腺癌巨噬细胞在化疗刺激后,IRENA表达量也显著上调,并且IFN-α可以促进IRENA的表达;重要的是,RNA干扰IRENA表达后,减少了NF-κB信号相关细胞因子,也消除了共培养肿瘤细胞的耐药性,但却未对JAK1-STAT1信号以及CD8+ T细胞的肿瘤免疫功能产生影响。RNA pull-down实验发现IRENA与蛋白激酶R (protein kinase R, PKR) 紧密结合,PKR也被报道参与NF-κB信号激活过程。随后的实验也证明,IRENA可以通过PKR二聚体 (PKR2–IRENA) 以促进后者磷酸化修饰水平,继而激活NF-κB细胞,促进肿瘤细胞的化疗抵抗性。这一调控机制也在巨噬细胞缺陷小鼠模型得到了验证。
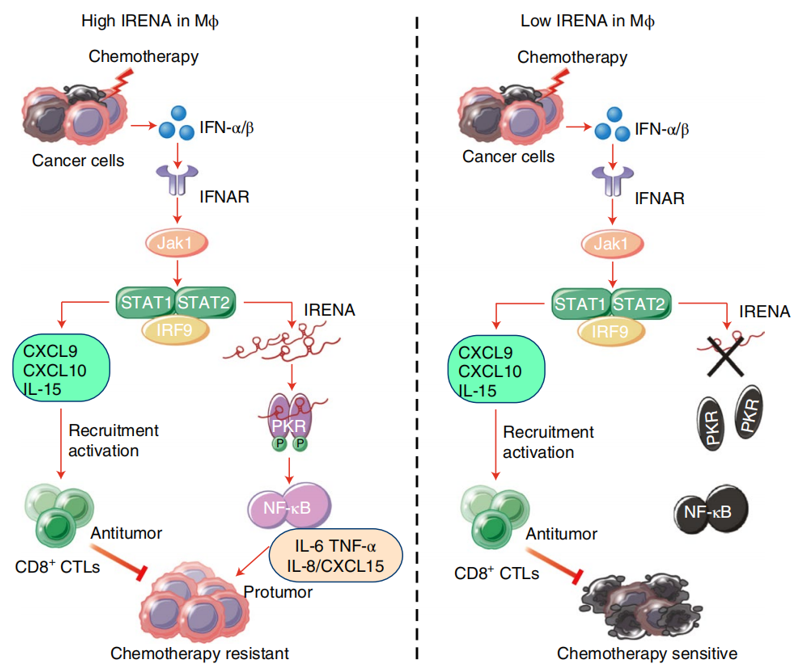
图3 TAMs调控肿瘤化疗疗效的分子机制示意图
总而言之,研究人员首次详细阐述了TAMs中IRENA/PKR/NF-κB影响化疗药物疗效的功能机制,并论证了JAK1-STAT1信号通路在肿瘤免疫功能调节中的具体作用,终而清晰地揭示了TAMs“双刃剑”样功能的信号调控机制。如今,大量研究提示TAMs是肿瘤治疗的重要靶点,许多影响TAMs数量或功能的药物也已在临床工作中正式投入使用。因此,此项研究工作结果也为将来TAMs相关肿瘤治疗药物开发的深入探索提供了新的基础与重要方向。
景杰生物为该研究提供了蛋白质组学技术支持及相关生物信息学分析。感谢中山大学孙逸仙纪念医院宋尔卫院士、苏士成教授研究团队的信任与支持!
参考文献
1、Jiang Liu, et al. 2021. The IRENA lncRNA converts chemotherapy-polarized tumor-suppressing macrophages to tumor-promoting phenotypes in breast cancer. Nature Cancer.
本文由景杰学术团队报道,欢迎转发到朋友圈。如有转载、投稿等其他合作需求,请文章下方留言,或添加微信ptm-market咨询。
https://blog.sciencenet.cn/blog-3404471-1289335.html
上一篇:食管癌进程的车轮 | 山西医科大学崔永萍课题组揭示TSTA3通过诱导糖基化促进食管癌发展
下一篇:寄生线虫免疫学研究新路径!华中农业大学胡敏团队报道寄生线虫N-糖基化修饰图谱