博文
【文献解读】NC10 bacteria in marine oxygen minimum zones
||
NC10 bacteria in marine oxygen minimum zones
The ISME Journal 10, 2067–2071(2016)
一、摘要
NC10门的细菌通过一种独特的、产生O2的、内部好氧的甲烷营养型途径将厌氧甲烷氧化与亚硝酸盐的反硝化作用联系起来。远洋中的NC10生态位尚未确定。本研究显示,NC10细菌存在于墨西哥北部和哥斯达黎加附近的低氧区(OMZs),并且转录活跃。在所有站位都检测到NC10的16S rRNA基因,并且在亚硝酸盐和甲烷浓度升高的缺氧区域中,其丰度达到峰值。甲烷单加氧酶颗粒基因(methane monooxygenase genes)的系统发育分析进一步证实了NC10的存在。与NC10匹配的rRNA和mRNA转录物在OMZ内达到峰值,并且这些转录物包括推定的亚硝酸盐依赖性内需氧途径的基因,其中包含NC10细菌一氧化氮(NO)还原酶独特基序结构的转录物的高度表达,它们被假设在产生O2的NO歧化反应中参加。这些发现证实了远洋OMZs是NC10的生态位,表明该组在OMZ氮、甲烷和氧循环中的作用。
二、主要内容
微生物在甲烷(CH4)的消耗中起着关键作用,包括由嗜甲烷菌完成的需氧甲烷氧化以及由依赖硫酸盐的古细菌完成的厌氧甲烷氧化(AOM),AOM被认为是甲烷循环重要的汇(Reeburgh,2007)。淡水生境的研究进一步将AOM与氮氧化合物的还原联系起来(包括硝酸盐(NO3-)和亚硝酸盐(NO2-))(Raghoebarsing et al., 2006; Haroon et al., 2013).。 最近发现的NC10门中还原NO2的细菌通过独特的依赖NO2的厌氧甲烷氧化途径(n-damo)将CH4的氧化与N2的产生耦合在一起(Raghoebarsing et al., 2006; Ettwig et al., 2009)。n-damo途径将NO2-还原为NO,这是淡水沉积物中的Candidatus Methylomirabilis oxyfera(氧化假丝酵母念珠菌)的特点(Ettwig et al., 2010),产生的NO被假定随后分解为N2和O2气体,其中O2作为需氧嗜甲烷菌内部的氧化剂。
n-damo的生态学意义和NC10细菌的环境分布情况仍然不清楚。依赖NO2-或NO3-的AOM的环境证据主要来自淡水沉积物和湿地(例如Deutzmann et al., 2014; Norei and Thamdrup, 2014; Hu et al., 2014),同时,NC10基因在多样的缺氧淡水生境(Shen et al., 2015)以及最近在中国南海富含NO2-的沉积物中被检测到(Chen et al., 2015)。然而,远洋中NC10细菌和n-damo的潜力仍然未知。
低氧区(OMZs)是依赖NO2-的n-damo的潜在生态位。在主要由上升流驱动的OMZ中,微生物的呼吸消耗[O2]导致缺氧(<10nM)(Tiano et al., 2014),包括东热带北太平洋地区(ETNP)中世界上最大的OMZ。在这些区域中,微生物将NO3-还原为NO2-的过程会驱动NO2-到达微摩尔浓度(Thamdrup et al., 2012)。OMZ的特征还在于CH4浓度的升高(Naqvi et al., 2010),低氧区也确实代表了全球开放海洋CH4的最大积累(Sansone et al., 2001)。尽管已在OMZ的代谢组学数据集中检测到与NC10细菌相关的序列片段(通过BLAST)(例如Dalsgaard et al., 2014),但仍然缺乏对远洋低氧区中NC10细菌生态位的确认。
本研究使用的样品分别来自从墨西哥北部近岸到近海过渡穿过ETNP低氧区的4个站位(6、8、10、11)以及位于哥斯达黎加Golfo Dulce(GD)缺氧海岸盆地的1个站位。本研究验证了“NO2-富集的OMZ持有类Methylomirabilis样NC10细菌”的假设。(补充图S1,补充表S1)。在这两个位置,[O2]都从表面下降,在深度为70–130 m时降至检测限以下(20 nM)(图1)。对于缺氧的OMZ,[NO2-]随氧气的消耗而增加,在ETNP的上部缺氧区(120-150 m)达到显着的最大值(4-5 μM),然后随深度下降。在GD中,缺氧区域中的NO2-在100 m处累积至0.7 μM。此处的亚硝酸盐在底部附近水层140 m处消失,其中硫化氢和铵的积累量在190 m处分别达到6.6和3.4 μM。
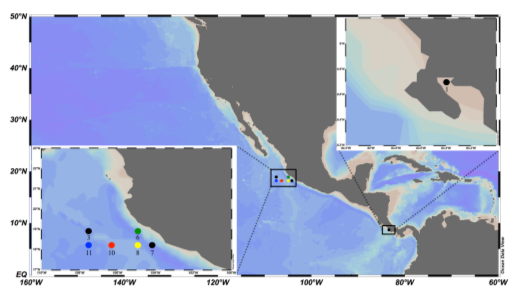
补充图S1 分别位于墨西哥和哥斯达黎加附近的ETNP和GD低氧区中的采样点。2014年5月,分别在6、8、10和11站收集了用于甲烷浓度分析以及n-damo细菌生化和分子分析的ETNP样品。2013年7月,在6和10站收集了用于分子分析的其他样品。图中还显示了3号站和7号站(黑圈),它们在2014年测量了厌氧氨氧化和反硝化作用速率(如正文所述)。GD的所有样品均在Golfo Dulce的最北端的1号站采集。
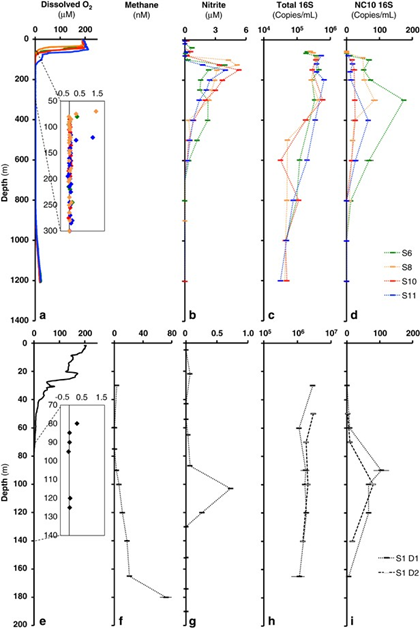
图1 ETNP低氧区2014年5月(a-d)和GD低氧区2015年1月(e-i)的水体化学和微生物生物量。ETNP站的梯度变化,颜色对应补充图1从近岸(S6)到近海(S11)。(a,e)溶解氧,基于标准海洋Clark型O2电极的溶解氧,小插图显示的为更高分辨率的STOX传感器测量值;(f)甲烷;(b,g)亚硝酸盐;基于对0.2–1.6 μm生物质部分的qPCR分析产生的(c,h)总生物量16S rRNA基因计数和(d,i)NC10特异性16S rRNA基因计数。ETNP的数据反映了2014年5月中旬使用CTD /rosette或pump-profiling系统的离散收集(每个深度)。GD数据反映了使用手工部署的Niskin瓶的离散收集(每个深度),其中D1来自2015年1月21日,并于1月23日(D2)获得了额外的16S计数样本。误差bar是重复样品之间的标准差(对同一[CH4]和[NO2-]的计算分别进行了两次和三次的重复;用于16S计数的qPCR进行了三次重复)。[O2]数据来自每个站点的代表性样品。校准方面的挑战阻碍了ETNP中准确的[CH4]测量(见文本)。
甲烷存在于ETNP和GD的缺氧区中。方法和校准方面的挑战使本研究无法确定ENTP样品中甲烷的确切浓度。然而,在ETNP站点低氧区深度的样品中仍然可以检测到甲烷,这与先前的研究一致,即沿26.8 kg m-3等密度线分布的ETNP CH4最大值反映了CH4来自于沿海沉积物中的平流移动(Sansone et al., 2001; Pack et al., 2015)。GD中的CH4曲线也暗示了这种CH4的沉积物来源,GD的[CH4]的含量在氧跃层以上NO2-的最大值位置处于约6 nM的痕量水平,而在硫化的底层水中处于约80 nM的水平。
使用NC10特异性16S rRNA(16S)基因引物进qPCR检测,在所有OMZ位点均检测到NC10 16S基因,其中ETNP的最大计数在约300-400 m的位置(25–174 copies mL-1;占16S总计数的0.02–0.05%)(图1)。这种分布表明,除了缺氧条件外,ETNP中的NC10细菌还与CH4相关联,而不是与来自上层的有机通量关联。因为如果与有机通量相关联,那么其应预计在有机营养活性最高的OMZ中达到计数峰值((Babbin et al., 2014)。在GD中,在90 m处NO2-和CH4富集区域的顶部16S rRNA计数达到峰值(105 copies mL-1;占总计数的0.006%)。在ETNP OMZ上方和下方以及GD OMZ上方,均检测不到NC10 16S rRNA基因或者NC10 16S rRNA均接近检测极限(6 copies mL-1)。
编码颗粒甲烷单加氧酶(pMMO)的pmoA基因可以催化嗜甲烷作用中的CH4氧化步骤,对该基因的测序结果进一步证实了NC10的存在。用NC10特异性引物扩增可从所有筛选的OMZ样品中回收到pmoA基因,这些筛选的OMZ样品是一个代表了所有站位的子集(补充表S1)。对克隆序列(ETNP中的26个和GD中的2个)进行系统进化分析,揭示了与NC10环境克隆中的pmoA和Ca. M. oxyfera(图2)有关的4种密切相关的系统型(>98.5%的共享氨基酸同一性)。这些NC10环境克隆中的pmoA和Ca. M. oxyfera序列与南海沉积物中的序列具有最高的相似性(Chen et al., 2015)(Chen et al。,2015)。这些序列的回收表明,OMZ中的NC10细菌可能会氧化CH4。
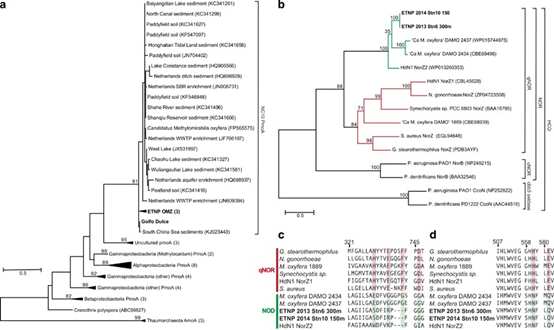
图2 OMZ中NC10的存在和转录活性的系统发育证据。(a)微粒甲烷单加氧酶亚基A(PmoA)基因系统发育。从ETNP和GD回收的PmoA序列(n = 53)在其他研究的较大NC10 clade序列进化枝中以粗体突出显示,它们与好氧嗜甲烷菌进化枝的PmoA和氨单加氧酶(AmoA)的外群分离。使用Dayhoff取代模型根据88个氨基酸的最大似然(ML)分析推断系统发育。展示的是大于70的Bootstrap值(自展值),以及数据库序列的NCBI编号。括号中的数字表示每个折叠节点中包含的唯一序列的数量——补充图S2中显示了所有序列的分类单元标识符和编号。比例尺代表每100个氨基酸50个氨基酸变化。(b)血红铜氧化酶(HCO)的系统发育遵循Ettwig等人的方法(2012)。推定的一氧化氮歧化酶(NOD)以绿色显示,包括由OMZ NC10转录片段组装而成的两个全长序列(标记为ETNP)。用于组装的序列是通过BLASTX与NIBI-nr数据库比对得到的与Ca. M. oxyfera具有最高匹配的序列(bit score > 50)。基于Le和Gascuel_2008模型,通过520个氨基酸的ML分析来推断系统发育。该树是按比例绘制的,其分支长度以每个站点的替换数来衡量。(c,d)依据Ettwig等人(2012)的方法,qNor结合(c)和催化(d)对苯二酚位点的排列展示了与标准qNor(红色)序列和推定NOD(绿色)序列的比较结果。编号指嗜热链球菌(G. stearothermophilus)的残基数。阴影突出显示了标准qNor序列中保守的残基,而假定NOD序列中已发生了氨基酸置换。
转录组结果证实,类NC10样细菌在OMZ内具有转录活性。对来自缺氧深度的5个2014年ETNP样品和3个GD样品的群落cDNA进行了鸟枪测序,并利用2013年6月来自ETNP 站位6的5个现有数据集进行了分析(数据集来自Ganesh et al., 2015)。NC10 16S rRNA转录本的相对丰度随着氧气的减少而增加,在ETNP核心(300 m)和GD的90 m达到峰值(补充表S2和S4),与最大NC10 16S基因计数的深度一致。在所有数据集中都检测到使用最低同祖先算法分配给NC10的Messenger RNA转录本。除了一个样品(150 m,ETNP站位10),NC10 mRNA转录物的相对丰度各不相同,与NC10 rRNA的分布平行,随着氧的下降而增加,并在ETNP OMZ核心中达到峰值,占总mRNA转录物的约0.1%(补充表S2)。
OMZ的类NC10样转录物库包含了那些在异化氮转化中具有预测作用的基因(补充图S3和S4,补充表S5和S6)。编码对苯二酚依赖性NO还原酶(qNor)的两个norZ基因丰度最高,共同代表51%最低同祖先分配给NC10的转录本。对于两个样品(ETNP,站位6,300 m,2013年;站位10,150 m,2014年),qNor转录物的组装产生了全长基因序列,该序列在系统上与qNor变体(bootstrap:100)成簇,由Ca. M. oxyfera基因组的基因座DAMO_2434和2437编码(图2)。在Ca. M. oxyfera富集时,NO2-还原过程中不会出现N2O(Ettwig et al., 2010),据推测,DAMO_2434和2437编码的qNor功能与NOD相似,将两个NO分子转化为N2和O2,而不是产生N2O(Ettwig et al., 2012)。的确,DAMO_2434和2437在对苯二酚结合位点和催化位点的关键残基处都有取代。此处回收的qNor序列也缺乏标准对苯二酚结合基序的保守性,并且具有与DAMO_2434和2437相同的催化位点取代(图2)。对这些候选NOD的鉴定增加了“OMZ中有亚硝酸盐依赖性的O2产生”的可能性。
在由最低同祖先算法确定的NC10转录物中没有检测到CH4氧化基因,包括那些编码pMMO酶的基因。但是,与Ca. M. oxyfera pmoB具有最高BLASTX匹配度的ETNP OMZ转录本,在ETNP中被检出具有较低的含量,但在GD中未被检出(补充表S6)。尽管该区域处于厌氧条件,在ETNP中仍未检测到有氧甲基营养型的pMMO编码转录本,但在GD OMZ的上部(90、100 m)中回收到该转录本。CH4氧化的NC10分配的转录物水平低可能是由于测序深度低或序列分类错误。或者,OMZ NC10细菌可以利用CH4以外的能量底物。
为了寻找n-damo的生物地球化学证据,本研究对OMZ的水进行了为期10天的13CH4和15NO2缺氧培养,以测量厌氧CH4氧化和N2产生的速率。在ETNP的所有分析深度处以及GD的3个分析深度中的2个深度(100、120 m)处,CH4氧化速率均低于检测极限(0.6 nM d-1)(补充表S7),这与已发表的文章中ETNP的低速率结果一致,也与ETNP和GD站位的NC10基因计数都低的结果一致。相反,在GD的90 m处,CH4的氧化的测量值为2.6±0.7 nM d-1,并通过添加pMMO抑制剂乙炔被抑制,这一结果表明,OMZ中的CH4被pMMO催化的AOM过程消耗。但是,在此深度处,从假定的需氧甲基营养型菌中回收到MMO转录本表明,由NC10产生的甲烷营养型活性很可能非常小。N2的生产率大大超过了GD中的CH4氧化率,这进一步表明NC10对固定氮损失的贡献很小(补充表S7)。
总的来说,这些结果确定了大洋OMZ是NC10细菌的生态位。在ETNP OMZ核心处的水停留时间估计为3.9±0.8年(DeVries et al., 2012)。有了这个估计值,并观察到GD中NC10 16S基因丰度的下降到与沉积物-水界面贴近的距离,表明这里检测到的DNA和RNA序列不太可能代表从沉积物中渗入系统的异源细胞。当然,n-damo的关键诊断酶的转录,特别是由qNor编码的假定NOD的转录,表明NC10细菌在OMZ氮和氧气的转化中发挥作用。尽管传统的反硝化作用和厌氧氨氧化作用无疑是OMZ中主要的氮汇,但由NC10产生的N2代表了一种附加的氮损失途径。NC10 pmoA基因的回收、与CH4和NO2-相关的NC10基因和转录本的垂直分布增加了OMZ中NC10消耗CH4的可能性,尽管这一预测仍有待验证。鉴于在OMZ中观察到CH4的富集,这些富集来自沉积物的对流(Pack et al., 2015)或可能来自OMZ产甲烷物质(补充信息,补充表S8,补充图S5),即使OMZ NC10细菌消耗CH4的速率低,也可能在开放海洋的甲烷预算中发挥重要作用。
补充图:
补充表:
41396_2016_BFismej2015262_MOESM84_ESM.xlsx
https://blog.sciencenet.cn/blog-3444937-1248446.html
下一篇:【文献解读】东热带北太平洋大洋最小含氧带生物固氮