博文
【文献解读】东热带北太平洋大洋最小含氧带生物固氮
||
东热带北太平洋大洋最小含氧带生物固氮(Biological nitrogen fixation in the oxygen-minimum region of the eastern tropical North Pacific ocean)
Amal Jayakumar, Bonnie X Chang, Brittany Widner, Peter Bernhardt, Margaret R Mulholland & Bess B Ward
The ISME Journal volume 11, pages2356–2367(2017) Cite this article
一、摘要
本研究在东部热带北太平洋(ETNP)的氧气最少区域(OMZ)贫氧水域(ODZ)的上方和内部对生物固氮(BNF)进行了调查。通过在孵育过程中直接测量示踪剂富集含量,使用同位素示踪法估算了BNF的速率,并且此方法克服了常规气泡法的不确定性。在近岸表层水域中,BNF的速率出现最高值(约每天4 nM),在离岸站位的缺氧区域中发现了BNF的最低检出率(约每天0.2 nM)。在大多数贫氧水的样品中均未检测到BNF。通过对nifH基因进行测序,本文研究了固定N2的组合物的构成。表层水的重氮营养组合(diazotrophic assemblage)主要包含Proteobacterial序列(Cluster I nifH),而缺氧水中发现了Proteobacterial序列和那些与序列特征为Cluster III和IV型nifH的厌氧微生物具有高度同一性的序列。我们的研究结果表明,在缺氧区域(ODZ)中,通过BNF适量输入的N主要归因于proteobacterial diazotrophs的活性。
二、引言
反硝化(包括厌氧氨氧化)的氮(N)损失、生物氮(N2)固定(BNF)的输入以及物理通量之间的平衡,决定了海洋中固定N的存量。在传统观念里,BNF通常与寡营养水域的透光层相关,而反硝化作用则是在水体和沉积物中都没有氧气的情况下发生的。
由于有机物的呼吸作用,在所有海盆中都出现了最小氧气区(OMZs),相对于周围水域,OMZ的溶解氧不饱和。仅在少数几个我们称为缺氧区(ODZs)的区域中,氧的浓度足够低,足以引起微生物的厌氧代谢。长期以来,人们已经认识到,ODZ是海洋中净氮损失的主要场所。也有人认为,由于与这些氮损失相关的氮有效利用量相对减少,并且氧气浓度较低(Mulholland and Capone, 2009; Großkopf and Laroche, 2012),以及ODZs中的可用铁浓度较高,所以在ODZ中也应优先考虑N2固定(Deutsch et al., 2007; Mulholland and Capone, 2009)。为了检验这一想法的主要研究都集中在东部热带南太平洋(ETSP)的ODZ,这是三个主要海洋ODZ之一,它们合计占全球海洋固定N损失的三分之一(Devol, 2008)。最近的研究报道了该地区表层水和深层水(缺氧)中的BNF(Fernandez et al., 2011; Bonnet et al., 2013; Dekaezemacker et al., 2013; Loescher et al., 2014),并基于nifH基因描述了多种重氮营养微生物的集合(Loescher et al., 2014; Turk-Kubo et al., 2014)。这些研究报告的缺氧BNF速率高达25 nM day-1(Loescher et al., 2014),这可能对总体全球BNF速率有显着贡献,并且这些研究还发现了新型的未知重氮营养型微生物,它们与已知的cyanobacterial N2 fixers(蓝细菌氮固定菌)不同。
全球海洋N预算通常假定生物N损失和输入过程大致平衡,但此类预算包含很大的不确定性,首先是用于对过程进行直接速率测量的方法以及此类数据的匮乏。用于测量N损失和N2固定速率的方法的最新改进极大地扩展了N循环的这两个主要途径的全球数据集。测量反硝化和厌氧氨氧化的Exetainer方法(Thamdrup and Dalsgaard, 2002)有助于直接测量海洋中氮的损失,而用气泡法测量世界许多海域的BNF率(Montoya et al., 1996)对于确定N2的固定方面也同样如此。但是,传统的气泡法可能会低估BNF的速率(Mohr et al., 2010; Großkopf et al., 2012)。这种不确定性使N2固定的直接速率测量的推算复杂化,难以与该重要的全球N预算方面的地球化学估算值进行比较。
本研究的目的是调查东部热带北太平洋(ETNP)中BNF的分布和大小,与ETSP相比,人们对此处N损失和N2固定的了解要少得多。在ETNP的ODZ及其周围地区,我们使用一种改进的方法对BNF进行了定量分析,该方法克服了气泡法的不确定性,并且避免了天然水样品受到平衡的浓缩海水的干扰。我们还通过对来自表层水和缺氧水的nifH克隆基因进行测序,研究了N2固定组合体的系统发育组成。
三、材料与方法
2012年3月至4月,在R / V Thomas G. Thompson船上,从ETNP的近岸BB1站位和离岸BB2站位之间的多个Casts中收集了水样(图1)。Casts 108、110、111、120和124都在BB1站,Cast 138、146和151都在BB2站。在另一个近岸站(Cast 103)和垂直于海岸的断面(Cast 134和163)以及沿110°W的子午线的断面(Cast 168、173和179)(图1)收集了其他样本。先前曾报道过BB1和BB2站位的水体高分辨率硝酸盐、亚硝酸盐和氧气浓度(Peng et al., 2015)。
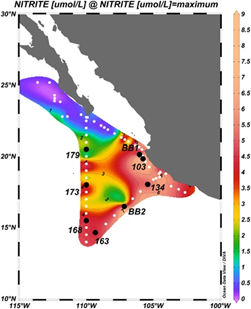
图1 站位位置图。BB1站包括Casts 108、110、111、120和124。BB2站包括Casts 138、146和151。白点表示巡航轨迹上的站位,这些站位用于得出最大NO2-浓度的背景轮廓,该轮廓定义了OMZ水域的氧气耗尽的水体。
用于BNF孵育的水样做3个平行,收集在CTD rosette(SeaBird Electronics, Bellevue, WA, USA)上的Niskin瓶(General Oceanics, Miami, FL, USA)中。黎明前从Cast中收集真光层样品的,并在装有隔垫盖的2.5 L透明聚碳酸酯瓶中孵育。将孵育瓶放置在甲板上的流通式培养箱中,在该孵化箱中用流动的表层海水以及使用CTD PAR数据估算、用中密度遮光网保持的原位光照条件对温度进行保持。
将ODZ样品在带有双入口的5 L透明聚氟乙烯Tedlar气密袋(Cole Parmer, Vernon Hills, IL, USA)中孵育,气密袋事先用酸预洗(10% HCl)、氦气吹扫、抽空,厚度为2 mil:两个入口分别是一个镀镍的黄铜软管倒钩,另一个是隔垫(Cole Parmer, Vernon Hills, IL, USA, EW-01409-92)。使用连接在软管倒钩上的惰性管将样品直接从Niskin瓶中转移到袋子中,并在填充过程中通过连接到隔垫的注射器将袋子中剩余的氦气清除。通过用氦气连续冲洗Niskin瓶的顶部空间,将集水期间的大气O2污染降至最低。ODZ样品在黑暗寒冷条件下的货车(12 ℃)中孵育(原位温度12–13 ℃)。
将15N2示踪剂((99%, Cambridge Isotope Labs, Tewksbury, MA, USA)通过隔垫注入瓶和袋中,目标浓度为~10%的环境N2。所有孵育的持续时间均为~24 h,以捕获真光水体中的整个昼夜的光照循环,因为真光层中的许多重氮型营养生物都表现出N2固定的昼夜循环(Zehr et al., 2007)。通过将培养液的全部内容物过滤到预先燃烧(450°C,2h)的GF / F过滤器(Whatman, UK)(标称孔径0.7 μm)上终止培养。将过滤器储存在-20°C,然后干燥并在锡盘中制粒,并在配备有自动氮碳分析仪的Europa Geo 20 / 20同位素比质谱仪(Little Chalfont,Buckinghamshire, UK)上分析同位素富集情况。为了表征和校正检测器对不同样本量的非线性响应的影响,运行了不同样本量的已知标准(定标),将预期样本量分组(Mcilvin和Casciotti,2010)。在GF / F过滤器上做三个平行收集,用于确定培养中颗粒有机物初始同位素组成的样品。使用公式(1)计算BNF的比率:
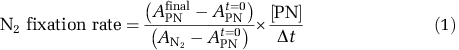
此处A =在孵育结束时(final)、开始时(t = 0)、溶解N2的pool中(N2)、颗粒有机N中(PN)测得的15N原子百分比(Montoya et al., 1996; Mulholland et al., 2006)。
方法的检测限是使用Santoro等人的方法计算的(2013)。不同的是,我们使用了3×而不是2×的仪器标准计算极限。就是说将7个标准品(每个浓度分别为12 μg N(0.0025%))的原子百分数乘以3,然后添加到每个样品的初始原子百分数测量中。这是最终颗粒原子百分含量的可检测最小浓度(Analytical Detection Limit Guidance & Laboratory Guide for Determining Method Detection Limits, Wisconsin Department of Natural Resources Laboratory Certification Program, April 1996, PUBL-TS-056-96)。然后,在每次测量的计算中强制使用该值,以说明颗粒氮浓度随深度和孵育时间的变化,从而使得每次测量拥有独立的检测限。平均检出限为1.0 nmol N L-1 day-1。由于样品之间颗粒氮浓度的巨大差异,有氧培养的平均检出限明显高于无氧培养的检出限(分别为1.4和0.5 nmol N L-1 day-1)。对于这个特定的测量,只有高于检测极限(above the detection limit = ADL)的速率才被认为是重要的。
由于在以N2为底物的孵育池中,15N2气泡逐渐平衡,导致15N原子百分数随时间的变化,为了估计这一变化,对过滤后的海水进行平行孵育:在保持原位温度附近温度范围(5-18.5℃)的条件下,在4个不同温度,对过滤后的海水进行2个重复平行。前10 h以2 h的间隔对样品进行二次采样,接下来每隔4-6 h对样品进行二次采样(直至24h),加入到注入He的12 mL的Exetainer(Labco, Lampeter, UK)中,然后立即加入0.05 mL 7M的氯化锌。使用Europa 20/20同位素比率质谱仪分析Exetainer中15N2的原子百分比。将每个温度下的独立多项式拟合到所得的时间相关的平衡曲线中。每个多项式从0到24 h进行积分,结果除以24,用于估计24小时孵育过程中样品孵育的15N2平均原子百分比。15N2的平均原子百分比范围从5°C下的3.9%到18.5°C下的5.5%(见Supplementary Figure)。
DNA / RNA序列分析
收集了五个深度的颗粒物质,用于nifH序列分析:BB1站的表层(0 m)、叶绿素最大值处(18 m)、亚硝酸盐次生最大值处(SNM,90 m);BB2站的表层(0 m)、和SNM处(150 m)。安装在CTD上的Niskin瓶中收集的全部水样(4–8 L)通过Sterivex-GP胶囊过滤器(Millipore, Inc., Bedford, MA, USA)过滤,在液氮中速冻并在液氮中保存并运输到普林斯顿大学。将样品保存在-80°C直到提取DNA / RNA。
使用试剂盒ALLPrep DNA / RNA Mini Kit(Qiagen Sciences, Germantown, MD, USA)从Sterivex滤器中同时提取DNA和RNA。使用SuperScript III First Strand合成系统(Invitrogen, Carlsbad, CA, USA),按照制造商描述的步骤(包括RT对照),在纯化RNA后立即合成cDNA。根据制造商的说明,使用PicoGreen dsDNA定量试剂盒(Invitrogen)对DNA进行定量。使用Promega PCR试剂盒(Promega, Madison, WI, USA),在MJ100热循环仪(MJ Research, Watertown, MA, USA)上,从环境DNA和cDNA中扩增nifH序列。如之前的研究所述(Zehr et al., 1998),稍作修改,使用嵌套反应:将25 μl PCR反应体系扩增30个循环(98°C下1 min,57°C下1 min,72°C下1 min),先使用外部PCR引物(Zani等,2000),然后使用内部PCR引物进行扩增(Zehr and McReynolds, 1989)。为了使扩增污染的可能性最小化(Zehr et al., 2003),每次PCR实验均设置阴性对照(使用高压灭菌和紫外线照射的水),将试剂稀释在新鲜高压灭菌的水中,在每天使用之前对PCR准备站进行紫外线照射,每次1小时,并且每次反应的循环数限制在30次以内。对除引物以外的PCR试剂也进行照射。然后分别测试每种试剂在阴性对照中的扩增。
将扩增的片段在1.2%琼脂糖凝胶上电泳,切下nifH带,然后使用QIAquick核苷酸去除试剂盒(Qiagen)进行纯化。根据制造商的说明,使用One Shot TOP10具有化学活性的大肠杆菌TOPO TA克隆试剂盒(Invitrogen),将纯化的片段插入PCR 2.1-TOPO载体中。这样一来,每个深度就产生了总共10个DNA和cDNA克隆文库。
随机选择克隆,并使用M13正向(-20)和M13反向引物扩增。使用Big Dye终止子化学试剂(Applied Biosystems, Carlsbad, CA, USA)在Macrogen DNA分析仪上对产品进行测序。序列使用FinchTV ver. 1.4.0(Geospiza Inc.,Seattle,WA,USA)进行编辑,然后使用BLAST检查身份。共性nifH序列(359bp)被翻译为氨基酸(aa)序列(修剪引物区域后为108aa),并使用ClustalX(Thompson et al., 1997)与NCBI数据库中公开的nifH序列进行比对。使用距离矩阵(distance matrix)方法(PAUP 4.0, Sinauer Associates, Sunderland, MA, USA)根据比对结果生成邻接法进化树(Neighbor-joining trees)。自举分析(Bootstrap analysis)用于评估系统发育重建的可靠性(1000次迭代)。产自甲烷单孢甲烷球菌(Methanosarcina lacustris (AAL02156))的nifH序列用作外群。新的ETNP nifH序列已保存在GenBank中,DNA序列登录号为KY967751-KY967929,cDNA序列登录号为KY967930-KY968089。
四、结果
水文学
缺氧区域存在于所有的采样站位。根据在相同航次、相同站位使用STOX传感器进行的测量结果(Tiano等人,2014),近岸站位水体从小于60 m的深度以及远岸站位水体从小于100 m的深度直到700-800 m可以被认为是功能性缺氧(O2浓度<100 nM)。在缺氧层中可检测到亚硝酸盐含量,最高的NO2-浓度(7 μM)出现在沿海站的100 m处(Station BB1, Cast 110; Peng et al., 2015)。在缺氧层中发现最高的NO2-和NO3-浓度,两者在表层水中都被消耗到亚微摩尔水平。图中显示了在沿海地区(BB1、103、134站;图2a)和远岸地区(BB2、163、168、173、179站;图2b)进行孵育的深度的水化学参数沿深度分布。
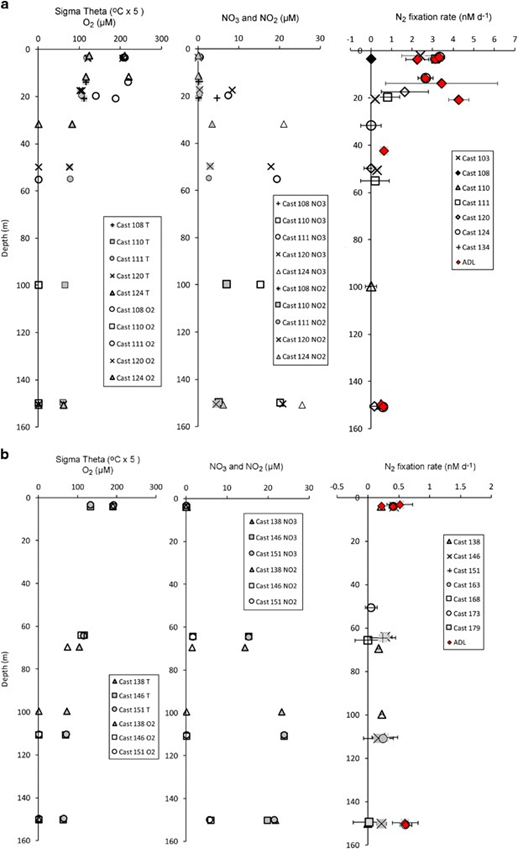
图2 近海(a)和近海(b)站的水化学数据和BNF率。红色符号表示高于检测限的速率(ADL)。所有其他速率均不显着。
N2固定率
9个表层样本(2-4 m)中的7个的BNF是高于检测限的(图2a和b中的ADL =红色符号),最大速率为3.3 mM·day-1。当高于检测限时,沿海站位表层水中的BNF速率平均为2.9(s.d. = 0.57)(s.d. = 标准差)nM day-1,离岸站为0.39(s.d. = 0.12)nM day-1。在沿海站,BNF速率的最高值在上部20 m处出现(图2a)。在沿海108站位20 m处采集水样中,记录到最高速率为4.3 nM day-1。在18个ODZ孵育中的5个站位,BNF是高于检测限的(平均值= 0.79,sd = 0.48 nM day-1),并且离岸站和近岸站之间有所不同。在134站位的200 m处,在ODZ深度处检测到的最大速率为1.7 nM day-1,而在ODZ中其他4个高于检测限的速率为<0.6 nM day-1(图2)。
在表层水中(图2),BNF的最高速率与亚硝酸盐和硝酸盐的最低浓度相关。缺氧水中的BNF速率低于表层水的BNF速率,且通常低于检测极限。图2中的误差棒代表3个生物重复样本标准差(即在3个单独的Niskin瓶中收集的水),它们表明BNF速率是否具有很大的变异性或小范围的板块状分布。
nifH多样性
从10个克隆文库中获得了343个DNA和cDNA nifH序列。大多数序列属于Cluster I(表1)还有大量的序列属于Cluster III和IV(表1)。
表1 nifH序列分布
Group | DNA | cDNA | Depths |
Cluster I | 126 | 86 | BB1-0M |
Alphaproteobacteria | 78 | 25 | BB1-0M |
Betaproteobacteria | 8 | 1 | BB1-90M |
Gammaproteobacteria | 38 | 57 | BB1-0M |
Deltaproteobacteria | 2 | 0 | BB1-0M |
Cyanobacteria | 0 | 3 | BB2-0M |
Cluster II | 0 | 0 | None |
Cluster III | 23 | 1 | BB1-0M |
Cluster IV | 33 | 74 | BB1-90M |
Total | 182 | 161 |
Cluster I
BB1和BB2站所有深度的样本均包含与Cluster I相关的序列(图3a)。大量的cDNA和DNA序列都分组到Methylocystis rosea,这是从北极湿地土壤中分离出来的一种新型的甲烷营养型菌(核苷酸同一性在87%和90%之间)。BB1站的3个深度处都有> 50个序列在这一alpha Proteobacterial的集群中,除此之外,还有来自阿拉伯海ODZ的序列(Jayakumar等,2012)。但是,阿拉伯海ODZ这一组中唯一的cDNA序列是从含氧水样的叶绿素最大深度处和ODZ深度处的水样中获得的,而且都来自于BB1站位。alpha Proteobacterial集群中的一个亚组,包含来自多个低氧环境的序列,包括阿拉伯海、ETSP ODZ、中国南海,红树林沉积物和Great Sippewisset沼泽(美国马萨诸塞州),但此处没有收集到来自ETNP ODZ的样本(核苷酸同一性介于92%和100%之间)。
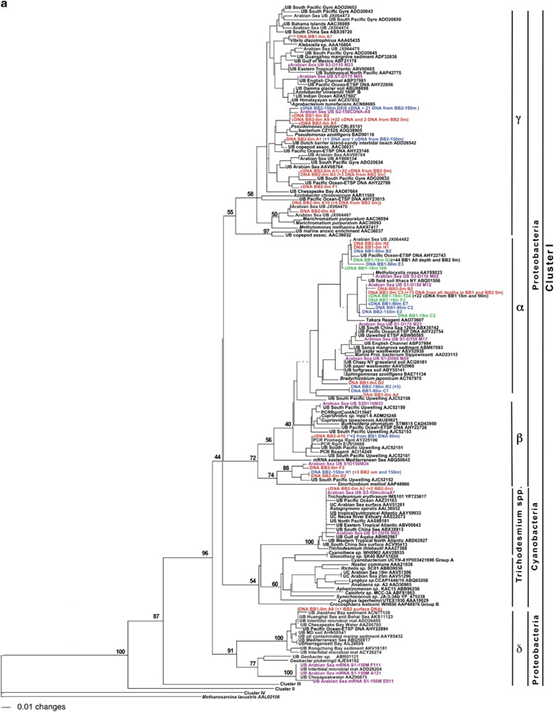
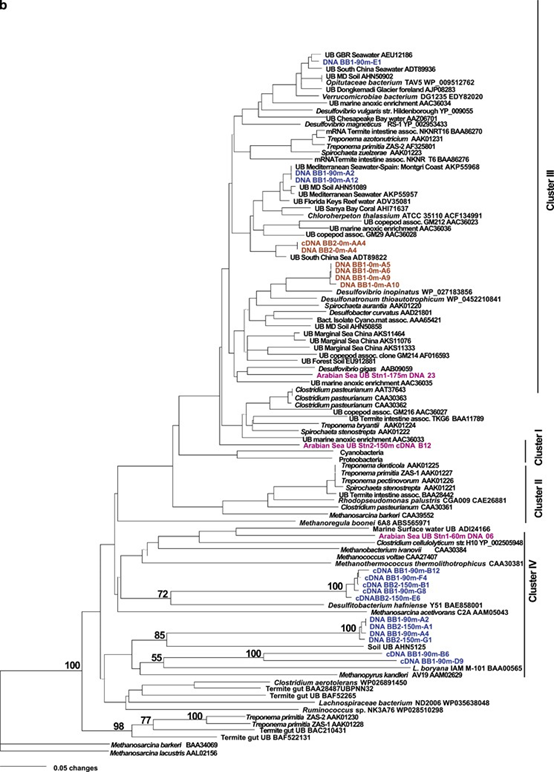
图3 nifH序列的系统发育树。本研究的DNA和cDNA序列以彩色突出显示,并标注了深度,结尾处标明了克隆编号:来自表面的样品序列为红色、叶绿素最大深度处为绿色、ODZ深度处为蓝色,紫红色的为阿拉伯海OMZ区域的样品序列(Jayakumar et al., 2012)。其他研究的序列为黑色,结尾为NCBI登录号。UB =未培养细菌。(a)nifH Cluster I中的nifH系统发育。(b)II,III和IV群集中的nifH系统发育。
很少有序列分组在β变形杆菌群中,但是α和β Proteobacterial的cluster之间没有明确的分离。β Proteobacterial cluster的9个ETNP序列中有6个,加上从ETSP上升流区域获得的1个序列(Fernandez et al., 2015),与苜蓿中华根瘤菌(Sinorhizobium meliloti)有关,这是一种α-Proteobacterium,其核苷酸同一性在68%至72%之间。其他3个ETNP序列不与任何已知的可培养细菌构成cluster,因此我们无法确定它们是否属于β或α Proteobacterial组。
有38个DNA和57个cDNA序列属于γ变形杆菌组(图3a)。来自沿海站BB1海水表层样品的1个序列与重氮弧菌(Vibrio diazotrophicus)具有高度同一性,重氮弧菌是一种与海洋蓝藻垫(cyanobacterial mats)相关的γ Proteobacterium(Zehr et al. unpublished)。在本研究中,许多聚集在γ Proteobacteria组别中的序列与任何可培养的γ Proteobacteria都没有紧密的同一性,但是与来自阿拉伯海ODZ和北太平洋回旋(gyre)处的序列具有紧密的同一性。
但是,来自两个站的表层样品以及BB2的ODZ深度处的几个DNA和cDNA序列都与P. stutzeri 和 P. azotifigens聚集在一起(90-91%的核苷酸同一性)。来自表层水的2个DNA序列和来自BB2 ODZ深度的一个cDNA序列与和copepods相关的序列以及来自Dutch barrier岛上潮间带沙滩上微生物垫的序列具有高度同一性。BB2表层样品的一些DNA和cDNA序列与来自南太平洋回旋(Gyre)序列密切相关(Halm et al. (2012); Turk-Kubo et al. (2014) 和 Arabian Sea Bird et al. (2005))。BB2表层样品中的8个序列与Marichromatium purpuratum纯培养物的nifH序列密切相关(Braun et al., 1999),这个序列是从浮游无脊椎动物富集中获得的。从阿拉伯海获得的序列也与此组密切相关。然而,在本研究中,没有检测到序列与Azotobacter vinelandii具有密切相关性,尽管在阿拉伯海ODZ中曾发现过与其具有高度同一性的基因(Jayakumar et al., 2012)。
在BB2站为的表层水样品中发现了3个cDNA序列与Trichodesmium erythraeum相同。它们与Church(2005年)等人报道的未培养Trichodesmium克隆具有98%的nt同一性,这一克隆是用来设计Trichodesmium qPCR测定被最广泛使用到的。没有发现与任何其他蓝细菌具有高度同一性的序列。来自同一样品的2个DNA序列与来自许多环境的序列非常相关:包括切萨皮克湾的水体、土壤、潮间带微生物垫和其他海洋环境。这一集群中的一个亚组与阿拉伯海ODZ和Geobacter物种的序列具有紧密的同一性。根据对Geobacter的亲缘性,我们将该亚组指定为delta Proteobacteria。
Clusters II, III, and IV
作为本研究的一部分,在ETNP中收集的样品中没有序列归类为cluster II的序列。在cluster III中,来自BB1沿海站位SNM深度的2个序列与从西班牙位于地中海的Montgri海岸获得的序列具有100%的同一性(Ribes et al., 2015; Figure 3b)。
BB1站位SNM深度的另1个序列与大堡礁附近收集的水样序列密切相关(83%核苷酸同一性)。这一cluster还包含来自Verrumicrobiae菌群的2个序列(从白蚁肠中分离出的Opitutacea细菌,这意味着能够分解纤维素;以及Verrucomicrobiae细菌DG1235)。这个门的细菌通常在富营养化的环境中发现。
来自海岸BB1站位的ODZ(SNM深度处)的2个cDNA序列彼此完全不同,但都在cluster IV中与Leptolyngbya boryana IAM M-101(固定N2的蓝细菌)分组在一起(Fujita et al., 1991; Figure 3b)。但是,Cluster IV nifH序列有编码叶绿素还原酶,并且不是固氮基因,但在蓝细菌中被发现。来自BB1和BB2的SNM深度处的4个序列与一种未培养的土壤细菌的序列(53%核苷酸同一性)聚类(Berthrong et al., 2014),来自SNM样品的一些cDNA序列与Desulfitobacterium hafniense(一种产芽孢厌氧细菌)聚类。
五、讨论
为了确定表层水和无光层水体中N输入的相对量及其相对于氧气浓度的梯度,本文在ETNP ODZ上方、之中和下方的垂直剖面中测量了BNF。在表层水中测得的最高N2固定率,但ADL的速率也只是在ODZ深度收集的少数一些样品中被检测到。
为了比较与N损失过程相关的BNF的大小并评估BNF在无光水层中的重要性,首先必须要获得BNF速率的准确估计值。最广泛使用的测量BNF速率的方法是“气泡法”,可能会产生对N2固定的低估(Mohr et al., 2010),这可能对平衡海洋N预算具有重要影响(Großkopf et al., 2012)。Großkopf等人在2012年计算得出,传统的气泡法导致整体N2固定速率低估了大约2倍。在气泡法(其中示踪剂以15N2气体的气泡形式添加)与“溶解”法(其中示踪剂15N2在过滤和脱气的海水中先预平衡,然后添加到培养体系中)的直接比较中,添加溶解的示踪剂导致N2固定速率比气泡法高了2–3.5倍(Wilson et al., 2012)。我们使用的方法旨在克服两种方法的局限性。气泡法的主要问题在于,从孵育的一开始就假定15N2示踪剂和孵化海水中的环境N2之间达到完全同位素平衡。然而,实际上,即使在24小时的孵育过程中,气泡N2也无法完全与水相的N2平衡,从而导致高估了溶解N2的池中的同位素富集度,并低估了计算的BNF速率(参见公式1)。而溶解方法的局限在于,需要大量的时间和操作才能过滤、脱气和用15N2与现场水预平衡,而且几乎不可能在合理的时间内生成足够量且能体现每个水样独特物理化学性质的富集水。富集海水的制备需要脱气,这一操作会改变其他的一些事情,尤其是通过二氧化碳脱气改变了碳酸盐的化学性质以及pH值。将其添加到样品孵育瓶中对微生物群落造成的影响是未知的。对于ODZ样品,会增加氧气污染的复杂性。
为了避免气泡法的局限性,我们采用了改进的气泡法来测量ETNP中BNF的速率。高度富集的示踪剂以气泡的形式添加到孵育体系中,但是在平行孵育中,对随时间推移的同位素富集量进行直接测量,这样一来可以知道实际的底物富集度。避免预平衡步骤,使我们能够在样品收集后迅速启动孵育,并监测实际的示踪剂富集,从而使我们能够更准确地计算15N2吸收速率。此外,分别测量每个速率时,如此处所应用的对检测限的严格确定可能比某些早期报告中的结论更可靠。
示踪剂15N2气体的污染最近已被确定为N2固定速率测量中的另一个潜在“伪影”来源(Dabundo et al., 2014)。我们使用Dabundo等人2014年的有限差分模型方法计算了从吸收15N污染物推断出的N2固定率:假设从剑桥同位素中发现的最高污染水平((0.052 μmol 15NH4+ per mole 15N2; Dabundo et al., 2014),以及本研究中发现的营养和颗粒氮浓度的测量值(additionally assuming ambient δ15N-NH4+=-2‰ and a specific growth rate coefficient of 0.3 day-1)。从15N污染物的潜在吸收推断出的N2固定速率范围从检测不到至0.019 nmol N-1 1-1-day-1,平均值为0.008 nmol N-1 1-1 day-1。这是该研究中测得的可检测到的N2固定速率(平均2%)的⩽7%,这表明该研究中观察到的15N的颗粒氮富集是由于N2固定而不是15N污染物的吸收所致。
最近一些关于OMZs中N循环的研究中,报道了N2的固定速率对示踪剂的添加使用了标准气泡法。在ETSP中OMZ的远岸水域中,表层水中的BNF率最高(高达0.9 nM day-1),在低氧深水(600 m)中检出的BNF速率最高为0.6 nM day-1(Bonnet et al., 2013; Dekaezemacker et al., 2013; Turk-Kubo et al., 2014)。 Loscher等人2014年的报告称,ETSP沿海站位表层真光区水体的BNF率非常高(~25 nM day-1),而该站位硫化物底水中的BNF率接近10 nM day-1。同样,在北大西洋沿岸的表层水中也观察到了较高的固氮速率(Mulholland et al., 2012)。但是,这些速率不仅可能由于上述方法学的欠考虑而被低估,而且还可能需要在更严格的检测限范围内进行有用的重新评估。
本文报告的BNF速率是ETNP ODZ中最早报道的BNF速率之一,因此将其与ETSP和其他地区的BNF速率进行比较是非常有用的。White等人在2013年报道了本研究区域内两个站位表层海水的综合固氮率低(基于气泡法),但由于没有提供深度剖面分布以及没有对ODZ的深度进行采样,因此难以进行直接比较。沿海站位BB1的表层水(总深度为2330 m)比Loescher等人在2014所研究的ETSP中硫磺类沿海站位的富营养化程度低。本研究采样的开放海域BB2站位于ETNP ODZ内。相反,Bonnet等人2013年在ETSP中对ODZ的外边缘进行了采样。BB1站测得的表层BNF速率高于ETSP进一步离岸测得的表层BNF率(Bonnet et al., 2013),但低于沿岸ETSP站点的观测值(Loescher et al., 2014)。BB2站测得的BNF速率与离岸ETSP站位的BNF速率相同(Bonnet et al., 2013),与ETSP近岸站位40 m处采集的样品(Loescher et al., 2014)以及南加利福尼亚湾的低氧水域(0.07-0.25 nM day-1; Hamersley et al., 2011)所测得的BNF速率相当。尽管此处报告的ETNP速率可能比使用标准气泡法获得的速率更准确,但它们的量没有太大差异。本文报告的速率在先前ODZ报告的速率范围之内,但低于先前表层水报告的速率。沿海表层水中的BNF速率与ETSP和其他地区的沿海表层水中的BNF速率相当(Mulholland et al., 2012),因此可以代表以前未量化过的固定氮源。
先前曾报道过在这个航次中同一站点处收集的样品的反硝化作用和厌氧氨氧化速率(B Babbin et al., 2014)。总的氮损失率在ODZ顶部附近最高,并呈马丁曲线(Martin curve)随深度的增加而降低(Martin et al., 1987)。在沿海BB1站位60 m处观测到最大的N损失率接近30 nM N day-1,BB1和BB2站位都在100 m附近出现约10 nM N day-1的N损失。相反,最大的BNF速率发生在上部20 m处的透光层,比N损失率最大值出现的深度要浅得多。在ODZ核心的深度(BB1处>60 m,BB2处>100 m),氮体积的损失率超过BNF率约20倍。
由于可靠的氧气浓度测量比较稀少,因此我们采用了Babbin等人2015年的方法。他们使用了校正后的《世界海洋图集》溶解氧数据库,并将ODZ水的溶解氧水平定为2.5 μM。根据这个定义,ETNP中缺氧水的体积估计为1.2 ± 0.5×1015 m3。ODZ的ADL的平均速率(0.79 nM day-1)乘以该处水的体积,得出ETNP缺氧水体中产生的总BNF率约为0.1 Tg N year-1。但是,此值应视为上限,因为它不包括在ODZ的大多数孵育中观察到的BNF零值。目前来看,全球水体的BNF率估计值为140 Tg N year-1(Deutsch et al., 2007)。测得的缺氧性BNF率表明,ETNP ODZ中的N2固定对全球N预算没有重大贡献。全球水体的反硝化率估计为70 Tg N year-1(Devries et al., 2011)。如果ETNP地区占全球水体氮损失的30%(21 Tg N year-1),那么我们估计的ETNP的年最大缺氧BNF速率0.1 Tg N year-1并不能显着抵消这一损失。
本研究的主要结论是,即使采用改进的孵育方法、灵敏的质谱、严谨的重复和可靠的统计分析,ETNP表层水和缺氧水中的BNF率仍然很低。我们在这里报告的数据集很小且变化很大,因此,在断定缺氧BNF不是N循环的重要组成部分之前,有必要对缺氧水体中的N2固定进行更全面的检查。
与本研究一样,来自ETSP无氧/缺氧水域的大多数nifH序列与cluster I相关,并且也与Proteobacteria的各个分支相关(Bonnet et al., 2013; Loescher et al., 2014; Turk-Kubo et al., 2014)。但是,与阿拉伯海不同,来自ETNP ODZ的大量序列也归于Cluster III和IV。
与ETNP相似,在ETSP中也发现了多种γ Proteobacteria(Turk-Kubo et al., 2014),但是qPCR分析表明,它们的丰度太低,不足以说明那里的BNF速率。这些作者认为,尽管亚表层水域中存在多种新型的重氮营养菌,但主要产生测得BNF的物质仍未确定,并且可能存在差异,以至于迄今为止一直没有被检测到。
尽管事实是在表层水中发现了最高的BNF速率,但我们却很少检测到与已知的蓝细菌N2固定菌相关的nifH序列。即使在亚热带海洋表层的几乎所有地方都发现了普遍存在的Trichodesmium群体,但在近海表面样本中仅发现了3个该群体的序列。同样,Turk-Kubo等人2014年在ETSP中仅检测到了3种蓝细菌的系统型,包括一种新型Trichodesmium型,仅占其克隆文库序列的4%,无法通过qPCR进行定量。本研究中,在表层水不太可能区分异养氮固定菌与蓝细菌氮固定菌。尽管蓝细菌重氮菌通常是表层水qPCR的目标,但异养重氮菌也可以从表层水的样品克隆文库中被检索到,并可能对真光层的BNF有所贡献(Mulholland et a., 2012)。依赖于PCR引物的扩增和/或克隆偏差是不能被忽略的,这是造成蓝细菌nifH序列检测量低的部分原因,但是蓝细菌的低比率及低丰度与该区域中N固定作用相对较小有关。在本文采样的站位区域,White等人在2013年检测到少量的Trichodesmium filaments,以及少量带有蓝藻的共生硅藻Richelia(cyanobacterial-symbiont-bearing diatom)。White等人还得出结论:重氮营养型对氮预算和下沉颗粒通量的贡献相对较小。
在固定氮浓度非常低的ETNP表层水中,BNF速率最高。但是,正如在大西洋沿海处所观察到的那样,固定氮的可用性似乎并不是BNF的主要控制变量(Mulholland et al., 2012)。在本研究中,我们在富含溶解无机氮(>20μm)的无氧水的硝酸盐跃层以下检测到了活跃的BNF(图2)。在该区域,有氧和无氧条件下、表层水和深水层中均检测到的主要重氮营养菌都是Proteobacteria,推测主要是异养菌。为什么N固定比溶解态的无机氮或有机氮的同化更容易发生尚不明确?
同样,虽然BNF被认为在低氧浓度下更容易发生,但我们却在有氧的表层水中测量到了最高的BNF速率。我们的结果与其他最近的研究一致,这些研究认为重氮营养的生境(包括黑暗的深层水)充满固定氮,此处的BNF是通过多种的异养重氮营养组合来完成的(Rahav et al., 2013; Loescher et al., 2014; Turk-Kubo et al., 2014)。
六、结论
在ETNP ODZ区域的表层和缺氧水中均检测到低水平的BNF。将ETNP表层水和深层缺氧水中以及在ETSP中以及其他地方的缺氧水体中的BNF发现综合在一起,得出:可能需要对全球氮预算进行重新评估,但不太可能有很大的改变。在ETNP中,BNF显然是由在高浓度的固定氮条件下的新型细菌群体完成的,因此本研究强调,需要重新评估我们对海洋中BNF调控的理解。
supplementary figure:41396_2017_BFismej201797_MOESM4_ESM.docx
https://blog.sciencenet.cn/blog-3444937-1254026.html
上一篇:【文献解读】NC10 bacteria in marine oxygen minimum zones