博文
均相反应的G-ξ曲线讨论
|
均相反应G-ξ曲线示意图是目前各类物化教科书讲授化学平衡时,普遍选用的教学参考插图,该图可动态、直观显示出(∂G/∂ξ)T,p与化学平衡的关联。
本文拟将该图使用的几点教学体会与同行分享,仅供参考。
1. 问题的导入
由均相反应的热力学基本方程可得:
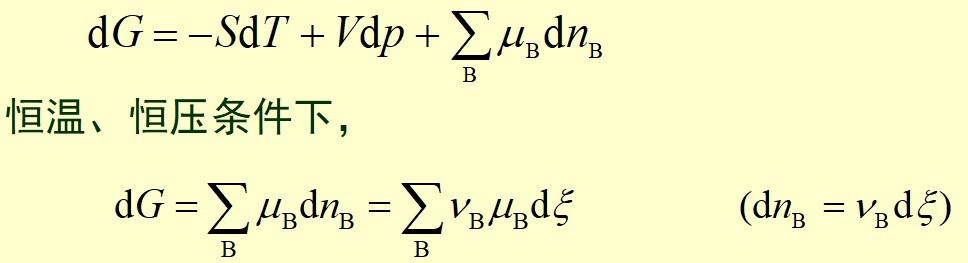
以均相反应的反应进度ξ为横坐标,绘制G-ξ曲线,则任一点的切线的斜率为:
![]() (1)
(1)
需要指出式(1)中ΔrGm应用前提是恒温恒压及反应进度介于0与1mol之间,这与热力学规定前提,即:恒温恒压及反应进度ξ=1mol并不一致.
2. 分析讨论
恒温恒压下均相反应的G-ξ曲线示意图参见图1.
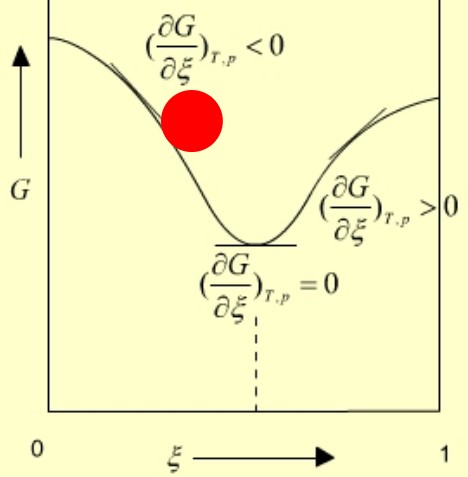
图1 恒温恒压下均相反应的G-ξ曲线示意图
由图1可以看出,反应进度ξ在0-1mol区间变化时,曲线上每一点对应的化学势μB均不相同,μB可视为反应进度ξ的函数(连续),其本质是一种数学拟合,与化学势偏摩尔量的本质并不一致。
热力学中ΔrGm的计算,是假设系统(平衡)组成恒定,即各物质的化学势均恒定前提下,所做的虚拟计算(ξ=1mol),该过程只能借助范特霍夫平衡箱实现。
平衡态热力学认为:改变图1中反应进度ξ,均相反应所经历的每一个点,均属不同热力学体系,类比它们的ΔrGm无实际意义
3. 结论
恒温恒压下均相反应的G-ξ曲线示意图,在热力学中无实际意义.
https://blog.sciencenet.cn/blog-3474471-1312223.html
上一篇:化学动力学中的动态平衡
下一篇:理想气体p-V图的热力学分析