博文
第一次申请省科学基金与结题小结
||





------------------------------------------------
浙江省自然科学基金资助项目研究工作总结(2013年度)
目 录
一、研究内容…………………………………………………………………………………3
二、研究方法…………………………………………………………………………………3
三、研究成果…………………………………………………………………………………7
四、研究结果的意义………………………………………………………………………15
五、本项研究工作对研究小组、实验室或学科发展所起的作用…………………………16
六、实际完成课题的研究人员及作用……………………………………………………16
七、建议与展望……………………………………………………………………………16
八、其它……………………………………………………………………………………16
茶黄素为红茶中多酚类化合物,最初是由Roberts等人从红茶提取物中分离鉴定,因呈橙黄色而得名。茶(Camelliasinensis (L.), O. Kuntze) 鲜叶本身不含茶黄素,但鲜叶在红茶加工过程中经过萎调处理和揉捻或剪切后,叶细胞的破碎促使叶内的儿茶素被酶促转化而成 (如下图所示) 。
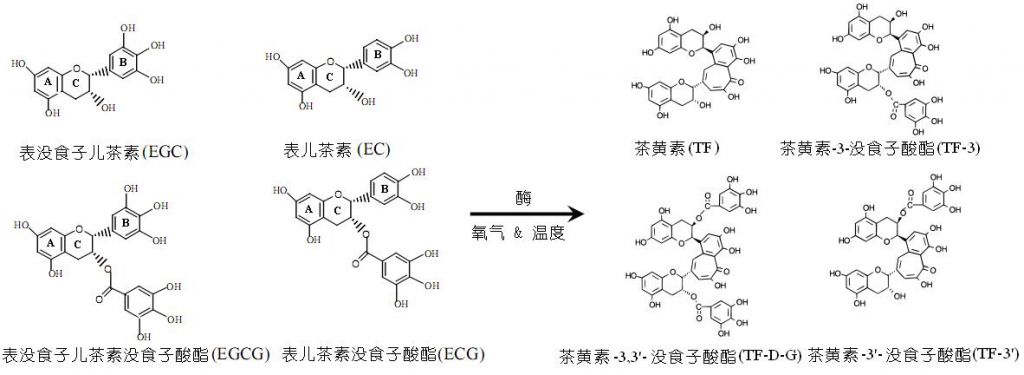
茶鲜叶中表没食子型儿茶素(EGC»EGCG) 的含量是表型儿茶素(EC»ECG)的3~4倍(摩尔数),酶促生成的4种茶黄素(图1)总量在红茶中应有6 %~8 %(w/w),但传统加工工艺制造的红茶中4种茶黄素单体总质量份数低于2 % (w/w),理解茶儿茶素体外酶促合成茶黄素的机理对于红茶实际生产品质控制可以起到指导作用;另一方面,茶黄素不仅是红茶的品质特征因子,而且具有降胆固醇、抗肿瘤、抗氧化,等功效,特别是茶鲜叶中的儿茶素及酶促合成的茶黄素具有丰富的酚羟基,可以清除活性氧如单线态氧、超氧阴离子自由基、过氧化氢、羟自由基,从而可以有效阻断促氧化致癌剂对细胞内遗传物质DNA的破坏作用。茶儿茶素及茶黄素不仅直接清除活性氧,其对体内氧化还原酶体系的作用亦能起到间接作用,阐述其内在的分子机制对于指导人们科学饮茶具有十分重要的现实意义。
一、研究内容
1.1 儿茶素单体茶鲜叶粗酶液酶促氧化规律;
1.2 配对儿茶素茶鲜叶粗酶液酶促生成与降解茶黄素规律;
1.3 配对儿茶素氧化顺序对茶鲜叶粗酶液酶促生成茶黄素的影响;
1.4 外源性化合物对茶鲜叶粗酶液儿茶素酶促生成茶黄素的影响;
1.5 儿茶素及茶黄素体外清除羟自由基的能力强弱变化规律;
1.6 儿茶素及其金属离子络合物影响胞内活性氧水平机制。
二、研究方法
2.1 酶活力测定方法
0.5 mL的粗酶液(同2.2),pH5.6的磷酸缓冲液(100mM) 1 mL,0.1 % 的辅氨酸0.2 mL,含一定浓度底物的水溶液0.2 mL混合后,37 ℃反应10 min,之后迅速加入1.5 mL的偏磷酸(1N)终止反应,于460 nm处测定溶液吸光值。
2.2 粗酶液的制备及酶促反应条件
将3 g冷冻(-30℃)的茶鲜叶置匀浆机中,加入5 g PVPP和预冷的磷酸盐缓冲溶液(pH5.6, 100 mM) 80 mL,匀浆5分钟后,用8层纱布过滤,置于4 ℃高速离心机(Sigma3K15,转子11133,转速5500转/分钟)离心50分钟后,将上清液置于冰箱中(-30℃)备用。

实验用茶鲜叶(金萱品种1芽2~3叶,2011年04月中旬采自浙江大学华家池校区茶园)、匀浆机及sigma离心机
0.4 mL粗酶液于10 mL刻度试管中,迅速加入一定体积儿茶素标准溶液(环境温度25 ℃)并用上述缓冲溶液定至1.5 mL,于37℃水浴中反应至一定时间再迅速(1 min.内)取800 µL酶促反应液置1 mL进样瓶中自动进样分析。
2.3 儿茶素与茶黄素含量测定
儿茶素与茶黄素采用美国Waters高效液相色谱仪(1525泵配备2487双通道紫外-可见检测器,柱温箱及717-Plus自动进样器,Breeze控制软件)进行定量分析(检测波长270 nm,进样体积10 µL)。色谱柱(Waters symmetryTM, Hypersil-C18, 150 mm´i.d.4.6 mm;柱温:25 ℃)洗脱条件参照已有方法[15]并作一定的修改:初始相100 %的流动相A(含有体积份数5 %乙酸乙酯和2 %醋酸的水)及0 %的流动相B (HPLC级乙腈,美国TEDIA公司)维持2分钟后,经过2分钟梯度变至75 % A 和 25 % B,维持10分钟,再1分钟内回到初始相,维持10分钟后(如下图所示),进行下一针分析。据上述方法所建立的儿茶素及茶黄素标准曲线(5~40 mg/L)分别为:YEGC=2896.7´CEGC + 2641.3,R2=0.9985;YEC=7183.9´CEC - 2317.1,R2=0.9995;YEGCG=18333´CEGCG - 5935.3,R2=0.9996;YECG=22591´CECG - 8854,R2=0.9999;YTF=13621´CTF - 5332.5,R2=0.9994;YTF-3¢ =7488.1´CTF-3¢- 1265.6,R2=0.9999;YTF-3=4552.4´CTF-3 - 2469,R2=0.999;YTF-D-G=14502´CTF-D-G - 19274,R2=0.9964 (Y: µv×Sec, C: mg/L)。

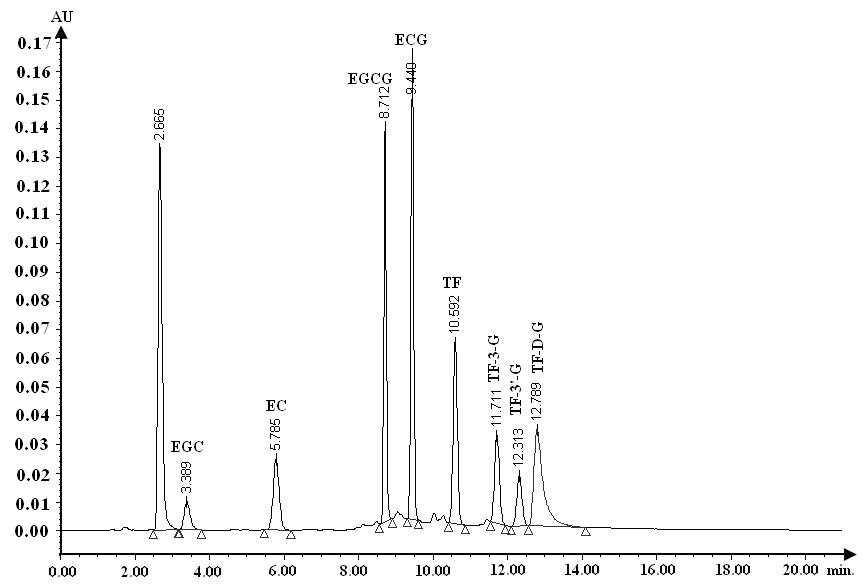
Waters高效液相色谱仪及其分离儿茶素及茶黄素色谱图
2.4 茶黄素单体的分离纯化
采用乙酸乙酯溶解市售茶黄素粗品后通过硅胶层析柱,得粗品茶黄素,再反复利用Sephadex LH-20凝胶柱系统分离纯化,洗脱体系为70%乙醇,按条带对分离馏份收集浓缩,并结合核磁共振氢谱及参考文献对分离的茶黄素进行成分与纯度鉴定。
2.5 羟自由基清除能力测定
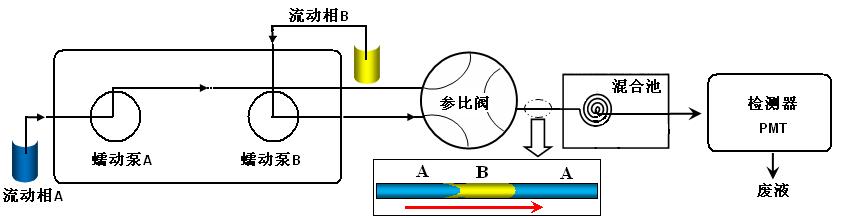
羟自由清除能力测定采用流动注射化学发光法,如下图所示。即将双氧水(8.4 %,v/v)通过六通阀注射进入约100 mL定量环,再与含有鲁米诺(2.0´10-4 mol/L)、Fe2+-EDTA (6.0´10-2 mol/L)及含儿茶素或茶黄素的磷酸盐缓冲溶液(pH 7.4, 0.05 mol/L)载流相混合后进入光电倍增管,记录化学发光信号。空白样以水取代儿茶素或茶黄素进行实验。其清除能力通过抑制发光体系(Fe2+-H2O2-鲁米诺体系)来衡量。清除率=(1-Si/S0)´100%,其中Si为实际发光面积,S0为空白发光面积。
2.6 儿茶素EGCG铜离子络合物(ECC)制备方法
取5 mL的水溶液(含有11.2 mM的磷酸二氢钾,8.8 mM的盐酸,10 mM七水硫酸铜以及30 mM的EGCG)于90 ℃水浴平衡后,逐滴加入等体积17.65 mM的氢氧化钠溶液(溶液最终pH为7.4),离心收集深紫色沉淀后,去离子水清洗2~3遍后冷冻干燥备用。
2.7 细胞内活性氧水平测定方法
8´104个细胞~10´104个细胞/mL接种于6孔板中,含10%FBS的高糖DMEM培养24小时后,换成基础培养液培养48小时,并进行药物处理一定时间后时加入DCFH-DA(PBS溶解)至10 mM,处理30分钟后,PBS清洗4~5遍后,收集细胞进行流式细胞仪读数(计数10000个,激发波长488纳米,发射波长525纳米)。
2.8 胞内氧化还原酶活力测定方法
胞内氧化还原酶活力(黄嘌呤氧化酶、超氧化物岐化酶、过氧化氢酶)测定采用南京建成生物工程研究所试剂盒测定步骤测定。
2.9 细胞内cDNA制备方法、及胞内氧化还原酶基因扩增引物片断
总RNA提取按碧云天Trizol试剂盒进行,cDNA按promega试剂盒获取,GAPDH、CAT、SOD1(Cu, Zn-superoxide dismutase)、EC-SOD3(extracellular superoxide dismutase)扩增所用前后引物依次为5¢-CATTTGCAGGGGGGAGCCA-3¢/5¢-TACTCCTTCGAGGCCATG-3¢,677 bp;5¢-TCTCATCCCAGTTGGTAAA-3¢/5¢- AGGGCAGAAGGCTGTTGTT-3¢,330 bp;5¢-GGGGAAGCATTAAAGGAC-3¢/5¢- TACACCACAAGCCAAACG-3¢,350 bp;5¢-GCCAAGGTCACGGAGAT-3¢/5¢-GCCAGCGGGTTGTAGTG-3¢,290 bp。
2.10 数据分析
数据以平均数±标准偏差表示 (n≥2),方差 (ANOVA)分析及均数比较(t-test, p<0.05 表示差异显著)采用Microsoft Excel-2003办公统计分析软件进行处理。
三、研究成果
3.1 儿茶素单体独立酶促降解速率表现为相似性
各儿茶素单体独立酶促降解行为如图1所示。儿茶素单独酶促反应损耗平均速率在2 min内主要表现为EGC (27.88 %) < EC (28.87 %) < ECG (36.76 %) < EGCG (44.81 %),2~4 min主要表现为EGC (10.62 %) < EC (23.05 %) < EGCG (39.18 %) < ECG (38.41 %),4~7 min主要表现为EGC (25.76 %) < EC (39.63 %) < EGCG (48.67 %) < ECG (49.56 %),7~9 min主要表现为EGC (7.96 %) < ECG (27.53 %) < EGCG (38.85 %) < EC (73.55 %);即7 min前,各儿茶素的损耗趋势基本一致,酯型儿茶素基本接近,并且酶促反应至25 min时,各儿茶素单体则亦消耗怠尽。
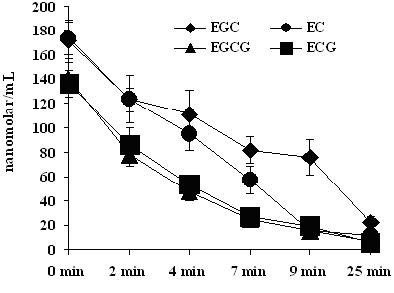
图1.独立酶促反应过程中儿茶素单体浓度酶促过程中随时间的变化规律(高效液相色谱法检测)
注: 4种儿茶素单体EGC和EGCG反应液自始至终为无色,EC和ECG反应液由浅黄色变为深黄色。
对比紫外-可见分光光度法检测结果(如图2所示),相同酶浓度下表型儿茶素(EC, ECG)随浓度的增加吸光值呈现出快速增长的规律,并且pH值对酶促的影响较为明显,即酸性条件下(pH5.6)更有利于ECG的酶促反应进行。但表没食子型儿茶素(EGC, EGCG)在酶促过程中其吸光值并没有明显随其浓度的增加而呈增长的趋势,因此(1)儿茶素在酶促降解过程中,表型与表没食子型儿茶素B-环苯环酚羟基上一定存在着不一样的酶促催化反应位点及氧化产物;(2)在酶活力评价中用邻苯二酚代替茶儿茶素测定结果不具有代表性,即儿茶素的降解行为利用分光光度法测定不具有合理性,相反,液相色谱的分离特性更适合酶活性的评价。

2. 紫外-可见分光光度法酶活力测定(不同pH条件下底物浓度与吸光值的关系)
3.2 配对儿茶素酶促降解速率表现为表没食子型儿茶素快于表型儿茶素,前者能有效降低生成茶黄素的进一步氧化降解
当表型儿茶素与表没食子型儿茶素两两配对酶促反应时(图3),各表型儿茶素(EC、ECG)的损耗率在9min前明显低于表没食子型儿茶素(EGC、EGCG),即表型儿茶素加快了表没食子型儿茶素的损耗,同时表没食子儿茶素减缓了表儿茶素的损耗。相应茶黄素的含量随之呈现出先增加后降低的趋势,自反应至7 min时所生成茶黄素TF及其单没食子酸酯的摩尔数与儿茶素消耗的摩尔数比值约为1,茶黄素双没食子酸酯的比值只有 0.62;在其后2 min的反应中除茶黄素TF增长外,其它三种都趋于稳定。比较9与25 min两个反应时间点,发现茶黄素降低的幅度依次为TF (76.56 %, t-test, P<0.05)>茶黄素TF-3-G (69.54 %, t-test, P<0.05)>茶黄素TF-3¢-G (66.71 %, t-test, P<0.05)>茶黄素TF-D-G ( 37.28 %, t-test, P<0.05);表没食子型儿茶素消耗怠尽时,茶黄素会随表型儿茶素的随低而降低,另外茶黄素双没食子酸酯的生成率低于其他茶黄素单体。表型儿茶素加快了表没食子型儿茶素的损耗,可能是由于表型儿茶素的酶促氧化生成的双氧水与过氧化物酶进一步氧化表没食子型儿茶素所致,但是我们通过在反应体系中加入过氧化氢酶前后,儿茶素的氧化速率几乎未受影响(数据未列出),同时我们亦发现茶黄素双没食子酸酯清除羟自由基的能力强于其它成分,而体系中该酯型茶黄素却并没有出现大幅度的降低,说明表型儿茶素与表没食子型儿茶素在酶促反应过程中存在着协同作用。
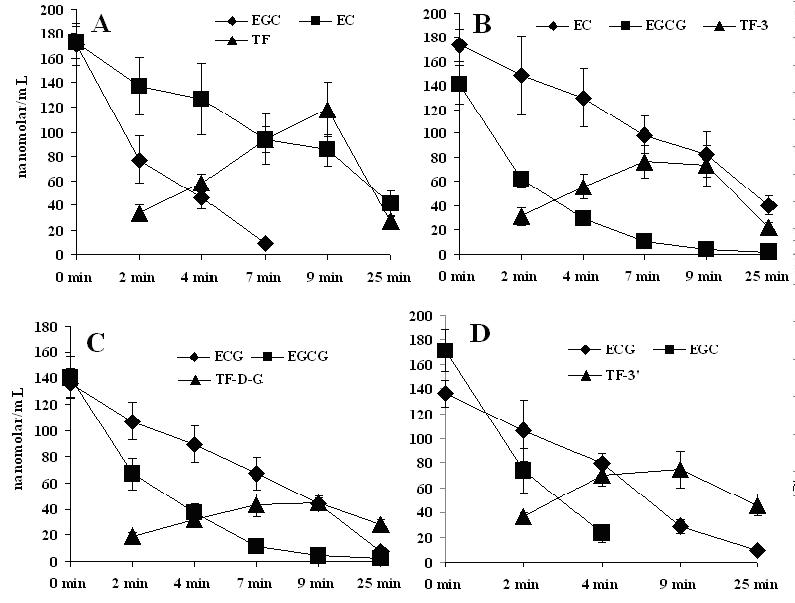
图3. 儿茶素两两组合生成茶黄素的浓度变化
注: A为EGC与EC组合在酶促反应过程中与生成的茶黄素TF浓度的变化;B为EGCG与EC组合在酶促反应过程中与生成的TF-3浓度的变化;C为EGCG与ECG组合在酶促反应过程中与生成的TF-D-G浓度的变化;D为EGC与ECG组合在酶促反应过程中与生成的TF-3¢-G的变化。
另外,图4A~C表明,酶促反应7 min时溶液中儿茶素浓度随酶浓度的增加而降低,而茶黄素在粗酶液添加量为0.4 mL时生成量基本达到最大值,随后茶黄素浓度随粗酶液浓度的增加变化很少,并且酶过饱和后酶促生成的茶黄素只与儿茶素的组成及浓度有关。实验过程中,我们亦发现简单儿茶素EGC 与EC在酶促反应生成茶黄素TF过程中会出现由浅黄转紫色(如图4-F所示),再转变成黄色,同是紫色出现时TF的浓度亦高,紫色褪去时,TF的浓度亦降低(数据未列出),并且紫色出现的时间随酶浓度的增加而缩短,而其它儿茶素组合酶促反应液自始至终只有黄色可见。
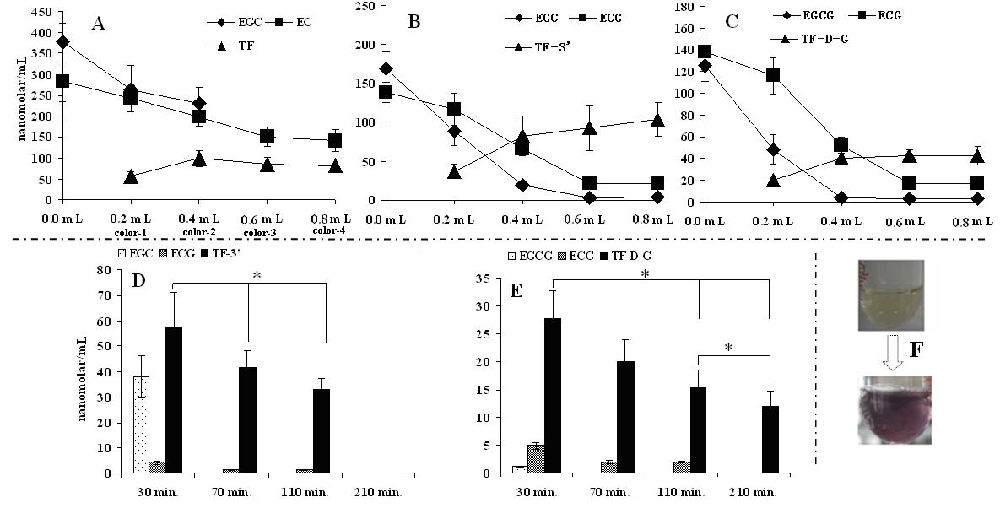
图4. 酶促反应中儿茶素及茶黄素的浓度(nanomolar/L)变化
注:A~C为两两组合儿茶素与生成的茶黄素浓度随酶浓度不同的变化(0.0 mL、0.2 mL、0.4 mL、0.6 mL、0.8 mL分别代表酶促反应体系中添加的粗酶液体积,酶促反应时间为7 min)。D~E为10倍摩尔浓度的表没食子型儿茶素与ECG (初始浓度为79.12 nanomolar/mL)在酶促反应过程中与合成茶黄素浓度的变化,*代表p<0.05。color-1~color-4为A在不同酶浓度酶促反应过程中紫色出现的时间:17 min、9 min、7 min、5 min,并在维持约16 min后由紫色变成黄色。
图4D~E说明过量的表没食子型儿茶素能够有效延缓茶黄素的损耗,但未能阻止茶黄素浓度的降低,另外TF-D-G在合成与损耗过程中都趋于缓和。实验过程中,我们发现粗酶液不对纯的茶黄素产生反应,同时EGCG或EGC的加入也不对茶黄素的浓度产生影响(数据未列出),但是EC或ECG的加入却能够随时间的推移而降低酶促反应溶液中茶黄素的浓度。
3.3 配对儿茶素同类型间存在竞争性生成对应的茶黄素
如表1所示,在由3个儿茶素构成的体系中,改变任一配对体系中儿茶素单体都会对合成茶黄素的浓度产生影响,即随着另一配对儿茶素量的增加,呈现出相应茶黄素量的增加,同样在EGCG与ECG的反应体系中,改变EGC的添加量,其相应茶黄素的量亦发生影响,并且呈现出协同正效应量效关系。另外,随反应的进行茶黄素亦基本消耗完,反应液出现了橘黄色絮状沉淀(图6-D)。
表1. 儿茶素浓度的变化对茶黄素合成的影响
摩尔比值
| 儿茶素 (nanomolar/mL) | 茶黄素 (nanomolar/mL) | ||||||
EGCG | EGC | EC | ECG | TF | TF-3' | TF-3 | TF-D-G | |
T1 | / | N.D. | 219.31±28.47 | 39.32±6.24 | 78.096±10.32 | 42.42±7.49 | / | / |
T2 | / | N.D. | 247.67±21.69 | 93.81±12.87 | 54.95±11.48 | 47.16±6.12 | / | / |
T3 | / | N.D. | 267.82±57.45 | 274.93±39.95 | 51.83±5.85 | 50.64±10.87 | / | / |
T4 | 29.06±2.87 | N.D. | 183.20±24.26 | / | 95.24±30.56 | / | 21.19±3.59 | / |
T5 | 43.08±4.85 | N.D. | 196.87±24.39 | / | 74.75±15.20 | / | 24.99±2.84 | / |
T6 | 5.54±0.61 | 43.48±5.83 | / | 32.45±5.55 | / | 36.55±4.79 | / | 31.38±4.89 |
T7 | 33.32±4.87 | 225.88±29.99 | / | 52.38±14.15 | / | 66.94±12.56 | / | 16.88±3.41 |
注:T1代表EC:EGC:ECG=1:1:0.5; T2代表EC:EGC:ECG=1:1:1;T3代表EC:EGC:ECG=1:1:1.5;T4代表EC:EGC:EGCG=1:1:0.5;T5代表EC:EGC:EGCG=1:1:1; T6代表EGCG:ECG:EGC=1:1:0.5; T7代表EGCG:ECG:EGC=1:1:1.5。N.D.表示未检测得到,“/”表示在酶促反应体系中本身不含有该类儿茶素或茶黄素。
3.4 配对儿茶素中,优先氧化表没食子型儿茶素的反应体系茶黄素的生成量高于其相反的顺序
在配对儿茶素酶促生成茶黄素反应体系中,儿茶素的添加顺序及酶促氧化方式对茶黄素浓度有着比较明显的影响。由表2可知,若先将EC酶促氧化一定时间(9分钟)后,再添加同摩尔浓度的EGC,反应9分钟后,其生成的茶黄素的量少于先将EGC 酶促反应相同时间后,再添加EC反应9分钟后生成茶黄素量的3.5倍,然而这两酶促反应的过程中如果先将任一单一儿茶素氧化,进行高温钝酶,再加入另一种儿茶素后,7分钟内并未检测出茶黄素的生成。在EGC与ECG的反应体系中,先将EGC氧化后加入ECG相比于先将ECG氧化后加入EGC会合成较多的TF-3¢,同时该反应体系中进行钝酶处理后,只能合成微量的茶黄素,并且静置过夜后会出现褐黑色沉淀(图5-C);有趣的是在钝酶后加入同体积份数的粗酶液会合成较多的茶黄素,并且在该体系中,如果将这两种儿茶素先单独氧化后,再合并反应,亦能合成相当量的茶黄素,但此时合成茶黄素的量要低于第一种情况下的将近2倍。
表2. 酶促反应过程中儿茶素添加方式对茶黄素合成的影响
处理方式 | 单体表型儿茶素 | 单体表没食子型儿茶素 | 茶黄素单体 |
T1 | 70.59±6.97 | 15.55±3.44 | 20.81±2.85a |
69.59±7.85 | 16.31±3.09 | 23.83±4.24b | |
26.90±2.85 | 22.61±2.08 | 10.99±0.59c | |
T2 | 140.10±23.17 | 46.71±10.96 | N.D.a |
151.26±24.17 | 26.07±3.41 | N.D.b | |
121.05±8.42 | 14.12±0.98 | 2.15±0.17c | |
T3 | N.D. | 86.22±16.40 | 69.17±7.75a |
0.49±0.11 | 58.32±7.74 | 61.59±13.95b | |
1.55±0.12 | 46.17±4.25 | 4.33±0.19c | |
T4 | N.D. | 161.36±20.78 | N.D.a |
T5 | 3.04±0.13 | 11.92±1.01 | 31.25±1.84b |
1.77±0.08 | 8.40±0.49 | 5.86±0.51c | |
T6 | 30.55±3.63 | 31.19±6.48 | 1.01±0.19b |
N.D. | 30.14±2.86 | N.D.c | |
T7 | 6.73±0.16 | 12.14±2.52 | 26.87±6.14b |
N.D. | N.D. | N.D.c |
注:T1为先酶促表型儿茶素9分钟,再加入表没食子型儿茶素反应7分钟;T2为先改变表型儿茶素9分钟,高温失酶活,再加入表没食子型儿茶素反应7分钟;T3为先改变表没食子型儿茶素9分钟,再加入表型儿茶素反应7分钟(反应液静置过夜会出现浅红黄色微量沉淀图5-E);T4为先改变EGC9分钟,高温失酶活,然而再加入EC;T5为表型与表没食子型先分别反应9分钟后,再合并反应7分钟;T6为表型与表没食子型先分别反应9分钟后,高温酶失活后,再合并反应7分钟;T7为表型与表没食子型先分别反应9分钟后,高温酶失活后,合并后再加入0.4 mL酶液反应7分钟。a, b, c, 分别代表TF,TF3¢,TF-D-G。EGC和EC的初始浓度分别为:166.84±18.84; 155.31±13.94 nanomolar/mL.

图5. 儿茶素酶促反应过程的溶液颜色变化与沉淀的形成现象
注:A代表EGC与EC酶促反应初始颜色;B代表EGC与EC酶促反应一定时间所出现的紫色;C代表EGC与ECG分别酶促反应后,高温灭酶合并后静置过夜出现的黑色沉淀;D代表表2反应静置过夜后出现的橘黄色絮状沉淀;E代表表3中的T3处理后静置过夜出现的浅红黄色微量沉淀;F代表表没食子型儿茶素氧化后静置过液出现的白色微紫的沉淀;G和H分别代表图4D和4E静置过夜出现的微量浅黄色沉淀。
同上,若是表儿茶素先氧化,而再加入表没食子型儿茶素,虽然能够合成一定量的茶黄素,但相应茶黄素的量要低于先氧化表没食子型儿茶素所生成茶黄素的量将近3倍,并且在反应过程中进行钝酶处理会使得在短时间内不能够实现茶黄素的有效合成。不同的是,在EGCG与ECG的反应体系中,不论先氧化EGCG还是ECG,相应茶黄素的合成量远低于其他组合合成茶黄素的量(摩尔比率),并且在独立氧化儿茶素单体后,再混合与钝酶后加粗酶液,这两种方式都不能够在短时间内合成可检测出的茶黄素应有的量。推测儿茶素酶促合成茶黄素的途径为茶鲜叶内源酶短时间内大量酶促儿茶素形成半醌自由基而致使茶黄素的高效合成(图6所示)。
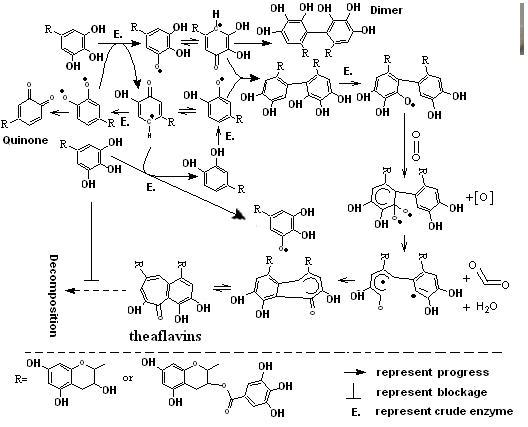
图6. 儿茶素酶促形成茶黄素的推测形成路线及表没食子儿茶素形成抗茶黄素降解机制
3.5 外来还原性化合物抑制茶黄素的有效合成,同时表面活性剂十二烷基磺酸钠SDS能够有效的提高儿茶素转化成茶黄素的比率,保护茶黄素不被降解
双氧水、还原试剂及十二烷基磺酸钠亦能够显著影响茶黄素的酶促合成过程,其中双氧水对茶黄素的酶促合成的影响呈现不规则变化,而还原性试剂的加入降低了茶黄素的酶促合成,同时也增加了茶儿茶素的保留率(图7、8所示);对于十二烷基磺酸钠(SDS)加入酶促溶液后,虽然茶黄素生成效率降低,即相同的茶黄素合成过程中,时间加长了,特别是当其浓度超过其临界胶束浓度,但是茶黄素的转化率及其在溶液中的稳定性均得到了大幅度提高(图8所示)。
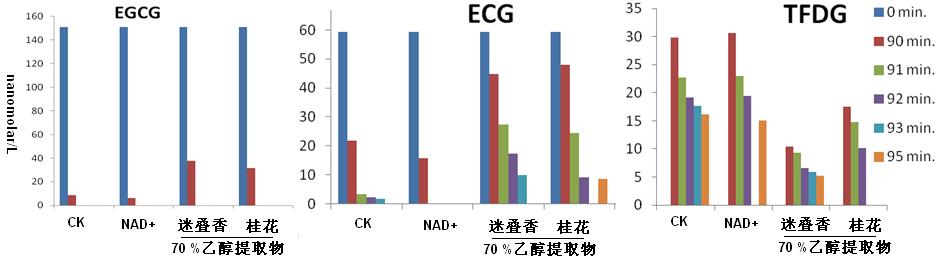
图7. NAD+,迷叠香及桂花70 %乙醇提取物对儿茶素酶促反应生成茶黄素的影响
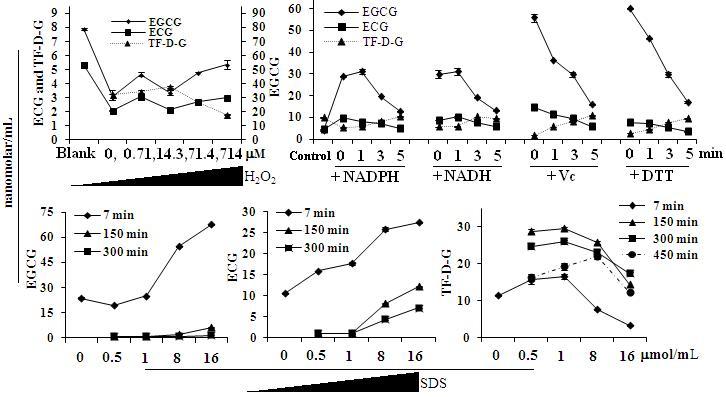
图8. 双氧水、还原剂及十二烷基磺酸钠(SDS)对茶黄素酶促合成的影响
3.6 儿茶素及茶黄素体外清除羟自由基能力的相互协同性较弱,而以独立性发挥抗氧化性为主
儿茶素体系中各成分清除羟自由基能力为:ECG>EC>EGCG,其中ECG的贡献率达到了43 %以上,而EGC在该体系中贡献不明显;酯型儿茶素---茶黄素体系中的羟自由基清除能力主要表现为:TF-D-G>TF-M-G>ECG>EGCG>TF,其中TF-D-G占对优势(贡献率为51.91 %), 而儿茶素清除自由基能力却未能有效发挥;每组中各成分之间的协同作用微弱(图9所示),相对于单因素来说,其总贡献率不足7 %。

图9 儿茶素及儿茶素与茶黄素间协同作用响应面与等高线图
3.7 儿茶素降低体外细胞内活性氧水平的能力主要依赖于其B环苯环上酚羟基的作用
茶叶中含量较为丰富的多酚类如EGCG、ECG、EGC以及没食子酸(GA),对结肠腺癌细胞RKO胞内活性的影响主要表现在降低其水平,并随时间其幅度越来越大(图10-A)。我们进一步通过实验将表没食子儿茶素没食子酸酯(EGCG)与铜离子络合后生成的络合物(ECC)对结肠癌细胞(RKO细胞)内活性氧水平的影响进行了考察,发现5 ~10 mg/L的ECC增强RKO胞内活性氧水平(图10-B),对于正常肠上皮细胞CCD(图10-C),20 和 40 mg/mL的ECC处理后,反而活性氧水平有所降低,其幅度分别约为对照的13.35 % 和19.72 %。另外,ECC处理后,RKO细胞内的黄嘌呤氧化酶(XOD)活性呈降低趋势,并且超氧化物岐化酶-1(SOD1)活性并没有随着其基因水平的增强而显著增强;但过氧化氢酶(CAT)虽然基因水平有了较大的提升(图11),其在胞内的生物活性却呈现出显著剂量依赖性降低。从而ECC对胞内活性氧水平的提升可能主要归因于胞内活性氧(过氧化氢)未能及时被活性降低的过氧化氢酶清除所致,又因经铜离子络合物络合的酚羟基对细胞癌细胞RKO表现出相反的效应,故推断儿茶素B环苯环上酚羟基的存在对细胞胞内活性氧水平的影响起到重要的作用。

图10. 茶儿茶素对结肠癌细胞及正常肠上皮细胞胞内活性氧水平的影响

图11. 儿茶素铜离子络合物对RKO细胞内黄嘌呤氧化酶(XOD), 超氧化物岐化酶(SOD) 及过氧化氢酶(CAT)活性及其对应基因表达水平的影响(#, 表示 p<0.05; # #, 表示 p<0.01, vs control 组)
四、研究结果的意义
儿茶素酶促合成茶黄素过程中受诸多外因素的影响(如温度、反应时间、氧气浓度,等)。本项目详细考察了儿茶素单体及其配对后的混合物在酶促合成茶黄素过程中的变化规律。并考察了儿茶素酶促方式对茶黄素合成影响,结果说明了茶鲜叶粗酶液(茶多酚氧化酶等)能够有效的催化儿茶素转变为茶黄素,表没食子型儿茶素的优先氧化是茶黄素高效合成的基础,同时表没食子型儿茶素在茶黄素酶促合成过程发挥稳定茶黄素的作用。然而非儿茶素类还原剂却表现为抑制茶黄素的合成。本项目研究结果对于红茶品质提升可以起到指导作用,其中利用十二烷基磺酸钠(SDS)增加儿茶素的转化效率,不仅可以指导高纯度茶黄素的酶促合成,而且对于今后人工合成模拟酶铺垫了基础。同时儿茶素细胞水平的抗氧化机制研究对人们科学饮茶亦可起到指导作用。
五、本项研究工作对研究小组、实验室或学科发展所起的作用
本项目负责人所在的科室为生化工程实验室,实验室团队对茶黄素的茶鲜叶酶促合成研究具有较为丰富的基础与经验。本项工作开展所获成果对本科室进一步深入研究茶鲜叶中的茶黄素酶促聚合机制及茶黄素与茶儿茶素聚合体的合成与分离纯化起到了推动了作用。
六、实际完成课题的研究人员及作用
本项目为一般性应用基础研究,实验的设计及数据采集主要由项目负责人完成。项目实施执行过程中参与人给予了工作与实验上的配合与帮助,使得本项目顺利开展。
七、建议与展望
我国是茶叶大国,浙江省为产茶大省,特别是杭为茶都对全国人民饮茶起到积极的带动作用。常饮茶可以强身健体,茶饮茶已经成为全球三大饮料之一。但是目前我省产茶茶园中只有春季产的茶叶得到利用,夏秋茶茶叶品质欠佳,大量资源未得到充分利用而白白浪费不采,对茶资源造成了极大的浪费。对茶鲜叶中酶促催化儿茶素转化成茶黄素的特性进行深入研究,可以促进茶叶的加工转型以及茶叶深加工分离纯化。茶资源在不久的将来将会得到更加充分的利用,更多的人们能够饮用不同风味的茶饮料及健康的高品质茶产品。
八、其它
鉴于本项目书中所列茶鲜叶中高纯度茶多酚氧化酶及茶儿茶素聚合体分离纯化的困难,高纯度多酚氧化酶的纯化及儿茶素低聚合体已开展相关实验,但未能得到实质性的实验结果。项目组已开展的实验已在前人研究的基础上对茶黄素酶促催化机制有了进一步较为深入的研究,其结果对茶黄素的酶促合成有了新的认识。项目组拟在结题后一如既往的继续完成高纯度茶多酚氧化酶的纯化工作,为深入阐述儿茶素酶促聚合机制及红茶品质的提升作铺垫。
https://blog.sciencenet.cn/blog-71940-722387.html
上一篇:Paired Ct. Transformed into Tf. by crude enzyme from tleaves
下一篇:我国茶叶产量近年来概况(2010年-2013年)