博文
新抗原癌症疫苗与肿瘤裂解物癌症疫苗的一次“PK”
||
在设计癌症疫苗和诱导扩增抗原特异性T细胞时,选择哪个癌症抗原或优先选择哪些癌症抗原,是决定癌症疫苗是否有效的关键因素。在这里,洛桑大学路德维希癌症研究所的Dr.Kandalaft实验室,利用她们的癌症疫苗平台比较了两种不同来源的癌症抗原,启动抗原特异性T细胞效果。这两种癌症抗原的来源分别是:一,全肿瘤裂解物(whole-tumor lysate,WTL),构建由WTL和树突状细胞(DC)为主体的肿瘤裂解物癌症疫苗 WTL-DC vax;二,癌症新抗原(neoantigen),基于新抗原和DC细胞为主的新抗原癌症疫苗 NeoAg-DC vax。全肿瘤裂解物中含有肿瘤细胞的全部蛋白,而新抗原是针对癌细胞特定基因变异而选择设计的抗原。通过比较这两种抗原的选择策略和技术路线,可以更好地了解哪种癌症疫苗设计更适合提高抗肿瘤免疫反应和更有利于临床的应用。
全肿瘤裂解物WTL-DC疫苗与新抗原NeoAg-DC疫苗对比研究的总体实验设计如下图所示:
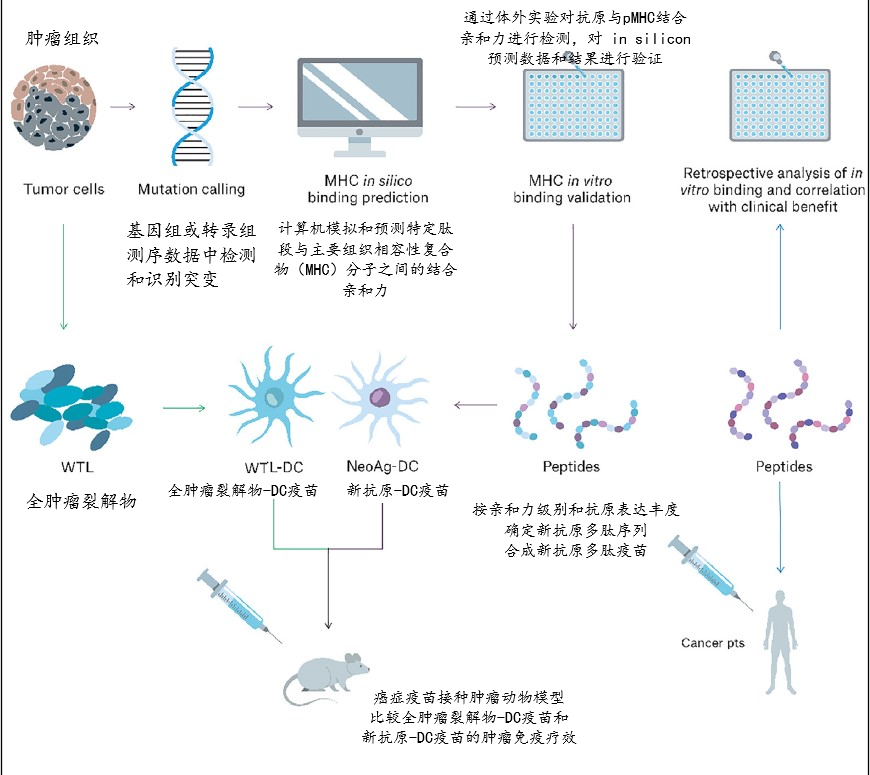
实验路径见下图,其中NeoAg-DC疫苗设计流程具体如下 :提取肿瘤细胞DNA和RNA →全外显子组测序&RNA测序,序列读取比对,变异检测(突变n=3106)和基因数据注释 → (In silicon peptide construction and HLA-peptide binding predictions)利用测序数据和计算机模拟方法(In silicon)构建突变相关肽段,并预测构建的多肽与HLA结合的亲和力,按亲和力强度,选择高亲和度肽段,排序列表 → 这个列表基础上进一步用RNA测序数据筛选,以HLA亲和度结合基因表达水平对肽段进行重新排序,优先选择HLA高亲合度,同时基因表达水平高,更具备可能启动抗肿瘤免疫反应的肽段 → 按预测选择的肽段序列合成抗原多肽 →(In vitro pMHC binding assay for peptides),通过体外实验验证候选多肽与MHC的结合能力。通过肽段驱动的重折叠实验,检测肽段在体外与它们对应的MHC/HLA分子结合的能力,帮助确定哪些肽段能够有效地结合到特定的MHC/HLA分子上。在多肽选择中通常会做pMHC binding的体外验证实验,最终确认NeoAg-DC vax的抗原多肽的选择 →(in vivo immunogenicity)多肽在体内免疫原性检测,通过体内免疫原性测试,可以验证潜在抗原或疫苗是否能够在真实的免疫系统中引发有效的免疫反应,以确保在实际应用中具有免疫保护效应。
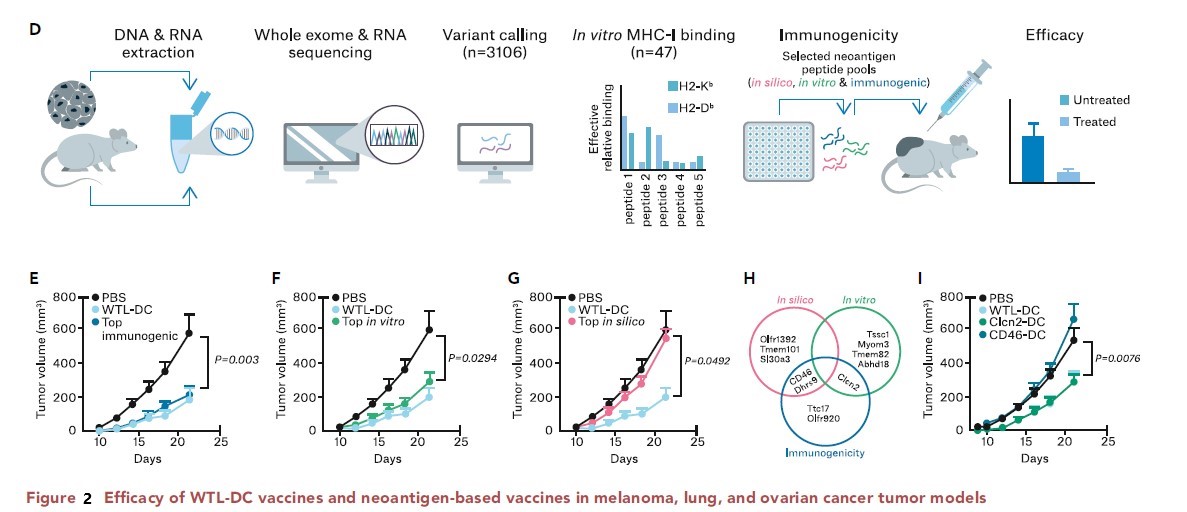
此项研究显示,全肿瘤溶解物(WTL)作为个性化疫苗的抗原来源在癌症模型中起到了控制肿瘤的作用,接种WTL疫苗的癌症模型中肿瘤体积增长明显小于对照组(图2 E,F,G)。之前的临床数据在卵巢癌胶质母细胞瘤患者患者和其他研究中也支持这一观点。
从in silico prediction,in vitro banding validation 和immunogenicity test三个维度对候选肽段进行排序,各优选等级最高的5条多肽(top5,图2H)。对不同方法筛选出的各top5肽段激活免疫反应的实验结果显示,通过计算机预测(in silicon analysis)的前5个肽段NeoAg-DC疫苗并未显示出有效性,而通过体内免疫原性检测或体外结合亲和性(in vitro MHC banding)筛选出的top5肽段NeoAg-DC疫苗激活了抗肿瘤免疫反应,与WTL-DC疫苗的免疫效果类似或疗效接近(图2 E,F,G,I)。表明体内免疫原性检测(immunogenicity)和体外MHC亲和力实验室检测(in vitro MHC banding)在筛选有效新抗原时可能比计算机预测(in silicon prediction)更为可靠。
说到体内immunogenicity尽管最为重要,在动物实验中才有意义,因为你可以利用动物做体内免疫原性的检测,找到最佳neoantigens。在人体接种多肽疫苗,实质上也就是等同通过clinical trial来确认NeoAg癌症疫苗的疗效了。因此,在研发NeoAg癌症疫苗时,必须优化in silicon prediction和in vitro MHC banding analysis ,使之在体外实验之前,就能预测和获得高度准确的新抗原多肽序列的优先排序。这样会显著提高新抗原疫苗的筛选效率和临床疗效。
综合研究结果表明,在新抗原癌症疫苗开发中,新抗原的选择和等级排序至关重要;目前单纯使用计算机程序预测(in silicon) 新抗原具有局限性,不一定代表具有免疫原性,例如in silicon预测的高MHC亲和力的新抗原肽Cd46W24S,在体外实验中表现较低的MHC结合力,在癌症模型中对肿并无免疫排斥作用(图2 H,I);体外MHC亲和力检测有助于进一步提高in silico预测方法筛选新抗原的准确程度,例如,in vitro MHC banding检测有高亲和力的新抗原肽Clcn2,在癌症模型中对肿瘤有显著抗肿瘤作用,与WTL-DC vax有类似的疗效;体内新抗原免疫原性检测(immunogenicity)会有效提高新抗原选择的准确性。
在现实状态下,尽管科学技术已有巨大进步,寻找适合临床接种有疗效的肿瘤新抗原仍然是一个困难的任务。由于用于训练AI算法的数据规模较小,影响T细胞识别癌症抗原的因素很多(如,共同受体、细胞因子等),以及癌症患者之间基因组变异的高度异质性,使得计算机系统对测序数据的分析和预测尚未达到很精准的水平。本项研究中的in silicon预测系统基本没能获得有效的新抗原。在6例患者中in silicon检测到新抗原中,分析确定的所有具有免疫原性(n = 31)和非免疫原性(n = 535)肽段的in silicon HLA结合得分,并没有显著差异。新抗原癌症疫苗公司的基本技术包括:基因测序和新抗原预测的生物信息学分析两个部分,看来进一步的完善需要加入体外pMHC 亲和力的检测系统。显然从基因测序,生物信息学分析和体外pMHC 亲和力检测的一整套技术管线,加上疫苗制备本身,目前还是相当复杂,繁琐,和昂贵的工作。
令人感兴趣的是,全肿瘤裂解物(WTL)不仅是个体化新抗原的丰富来源,研究结果也支持使用WTL作为个体化癌症疫苗的抗原来源来实现肿瘤控制。WTL疫苗制备过程简单,不像新抗原疫苗的技术门槛那么高,临床应用的可行性很大。但是,目前可以利用的大样本随机对照性研究资料很少。几十年前国内曾经流行过的“瘤苗”,大概就是属于这一类,后来似乎没能坚持下来。我也曾经做过这类工作,在不同实体瘤中总共大约做了10多例。有些是在国外实验室制备的,先是裂解肿瘤组织,用分子筛离心过滤,获得小分子的癌症抗原蛋白和肽段,再加入GM-CSF作为免疫佐剂和赋型剂山梨醇,分装入安瓶后,最终在冻干机里冻干封瓶,虽然是作坊式的手工操作,产品看起来还是不难看。这10几例患者也没能随访,两个患者是结肠癌术后患者,各自都定时皮下接种我制备的癌症疫苗,治疗长达一年左右,现已经过了20多年,没有癌症复发,应该说他们的癌症已经治愈,是不是“瘤苗”的疗效,“You never know”。他们现在都活的很好,我们也都成了朋友。或许,这种“瘤苗”的免疫治疗的努力从当初坚持到现在,会有不一样的结果。看到这项“瘤苗”与新抗原癌症疫苗的“PK”,还是有些感触。
Cancer vaccines based on whole-tumor lysate or neoepitopes with validated HLA binding outperform those with predicted HLA-binding affinity. iScience April 2023
阎 影 王霞
https://blog.sciencenet.cn/blog-3302154-1431052.html
上一篇:令人期待的新型可吸入性给药的肺癌治疗方法
下一篇:CAR-T疗法引起的继发性肿瘤