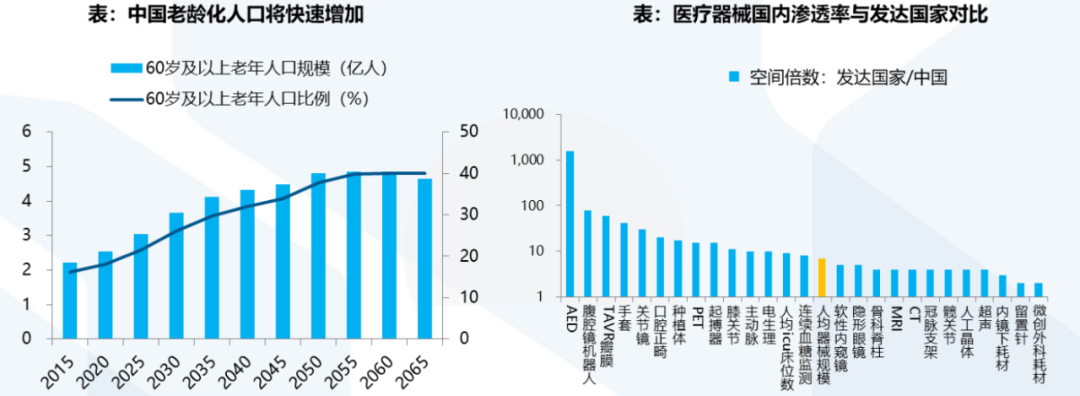
医疗器械指直接或者间接用于人体的仪器、设备、器具、体外诊断试剂及校准物、材料以及其他类似或者相关的物品,主要通过物理等方式获得效用,包括医疗设备和医用耗材等。人口老龄化趋势下,中国医疗器械需求总量稳定提升,器械产业发展配套政策逐渐完善,医保局带量采购政策不断“进化”。根据《“十四五”医疗装备产业发展规划》,预计到2035年,中国医疗装备的研发、制造、应用将提升至世界先进水平,进入医疗装备创新型国家前列,中国将诞生世界级医械公司。受疫情影响,医疗器械行业成为全球最受关注的行业之一,国家发改委已将医疗器械、医疗用品和医疗服务列入《战略性新兴产品重点产品和服务指导目录》。在鼓励国产化、优先国产化、采购国产化等国家政策的大力扶持下,我国医疗器械企业替代进口的能力得到大幅提升,我国医疗器械行业迎来快速发展时期。
医疗器械行业都包含哪些产品?市场规模有多大?新医改对医疗器械行业的影响如何?产业链及细分领域都有哪些行业特性?有哪些公司?未来趋势如何?下面我们将逐一分析。
01
行业现状
1、按产品特性分为四类
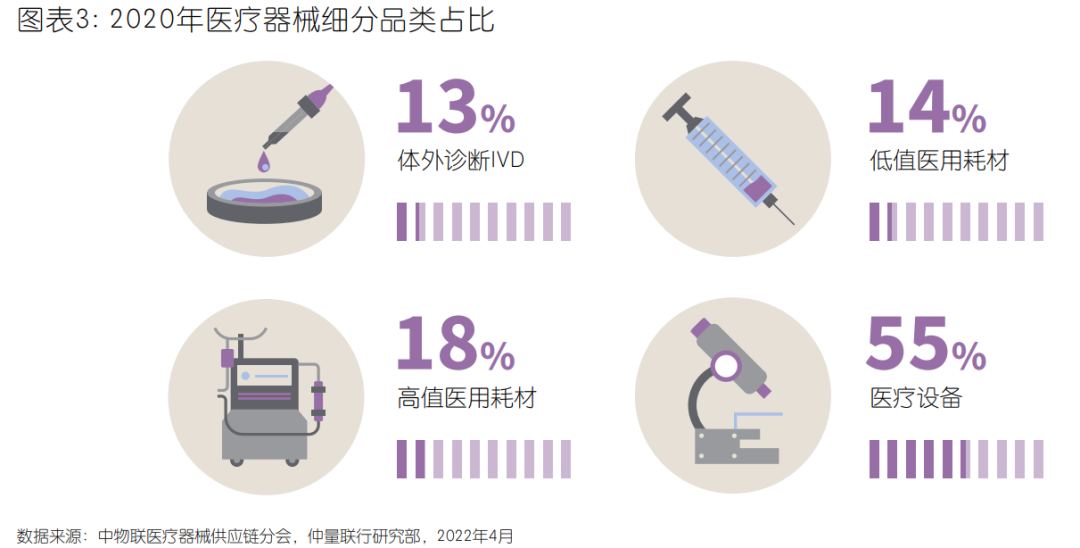
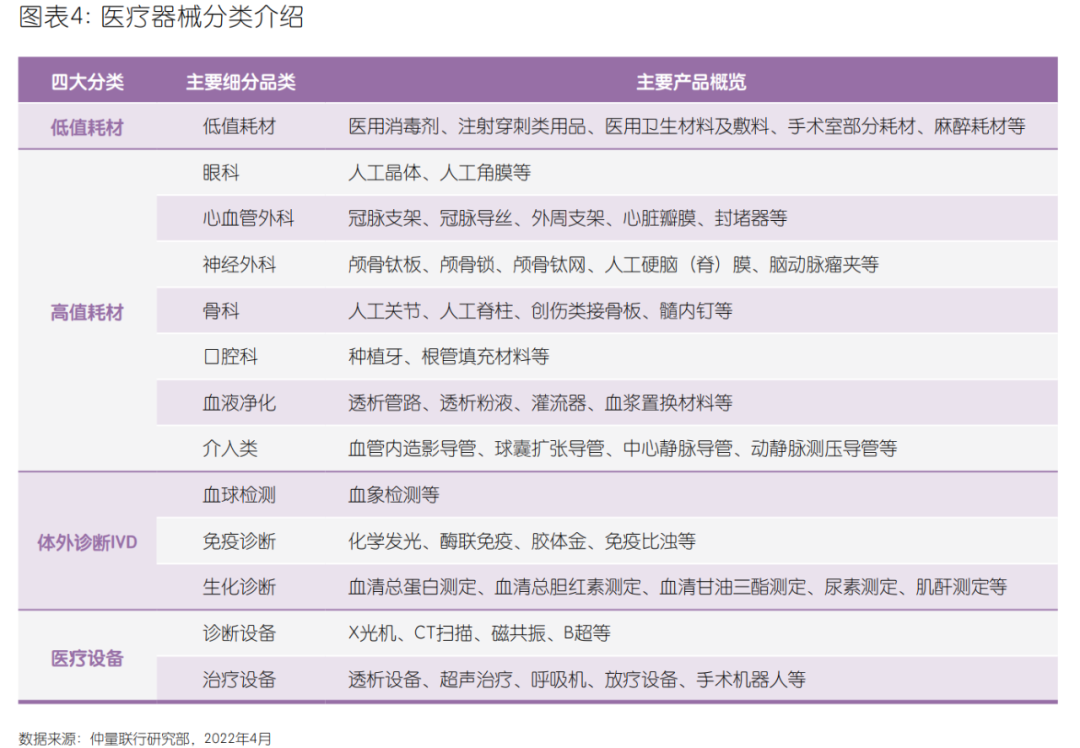
医疗器械可以按产品特性大致分为低值耗材、高值耗材、体外诊断、医疗设备四大类。我国医疗器械产品种类繁多, 产品间差异极大,但单一领域的市场规模和空间相对有限。每个领域的产品用于不同病种,而不同病人的诉求又有巨大差别。因此造成了医械企业经常面对行业细分领域天花板的压制,以及跨界竞争的挑战。
2、按风险程度分为三类
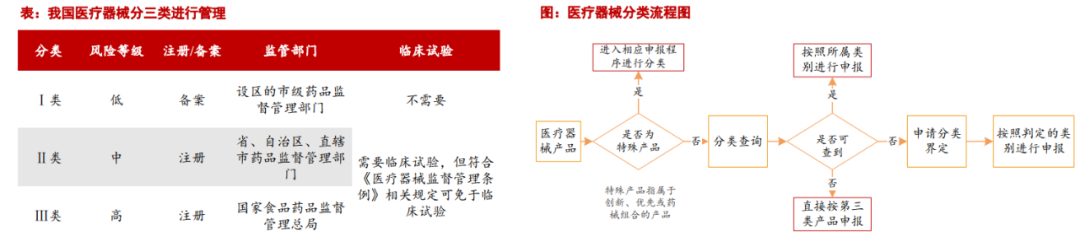
安全性是器械审批注册的主要分类标准。据药监局发布的《医疗器械分类目录》,我国医疗器械按照风险程度分为三类:1)第一类风险程度低,实行常规管理可以保证其安全、有效的医疗器械,仅需备案管理,监管部门是设区的市级药品监督管理部门;2)第二类具有中度风险,需要严格控制管理以保证其安全、有效的医疗器械,需要申报注册,监管部门是省、自治区、直辖市药品监督管理部门;3)第三类具有较高风险,需要采取特别措施严格控制管理以保证其安全、有效的医疗器械,需要申报注册,监管部门是国家食品药品监督管理总局。关于临床试验,办理第一类医疗器械备案,不需进行临床试验;申请第二类、第三类医疗器械注册,应当进行临床试验,但有《医疗器械监督管理条例》规定情形的,可免于进行临床试验。医疗器械类别的判定可以根据《医疗器械分类规则》或《医疗器械分类目录》进行查询。
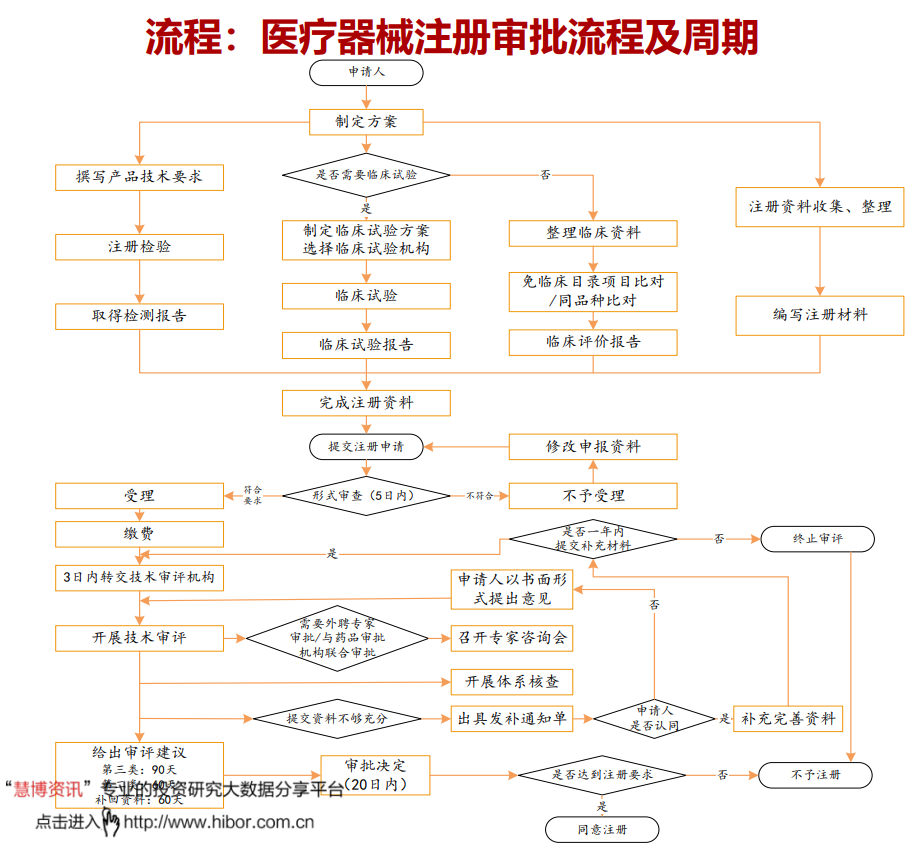
3、注册审批流程及周期差异大
不同等级、类型、特点以及地区的产品审批周期差异较大,按照普遍情况来看:二类械审批周期:不含临床约1~2年左右,含临床1.5~3年左右,甚至更长;
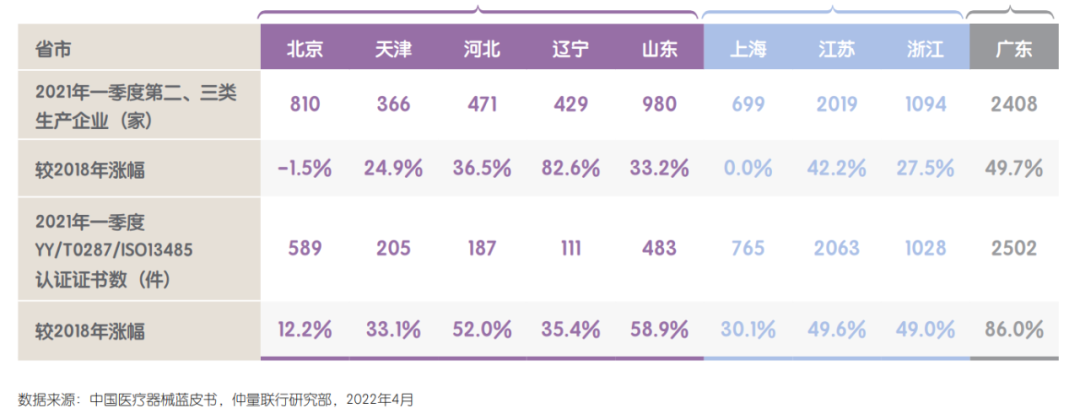
4、我国已初步形成三大医疗器械产业聚集区
从我国第二、三类医疗器械生产企业所在地,以及二、三类器械产品质量管理体系认证证书颁发地情况来看,我国医疗器械产业已初步形成珠三角、长三角和环渤海三大聚集区;且过去两年,三大区域器械生产企业和获批产品数量均持续保持高速增长。北京、上海、天津、广东、江苏、浙江、山东、河北等省市企业聚集度和产品数量位居全国前列。这得益于以上地区长期较强的外向型制造业经济特征,民营经济活跃,制造业基础扎实;同时由于疫情以来海外医疗器械产品需求量大增,带动出口快速增长,成为医疗器械企业及产品增长重要推动力。
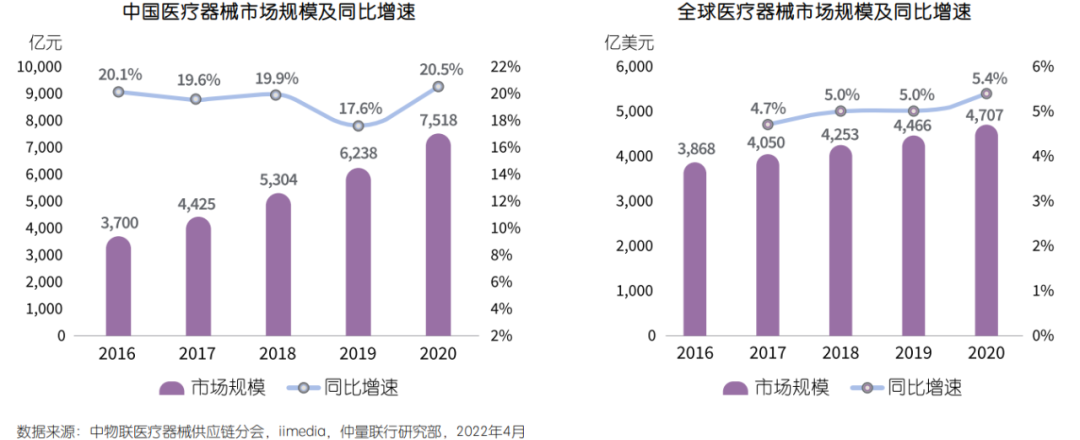
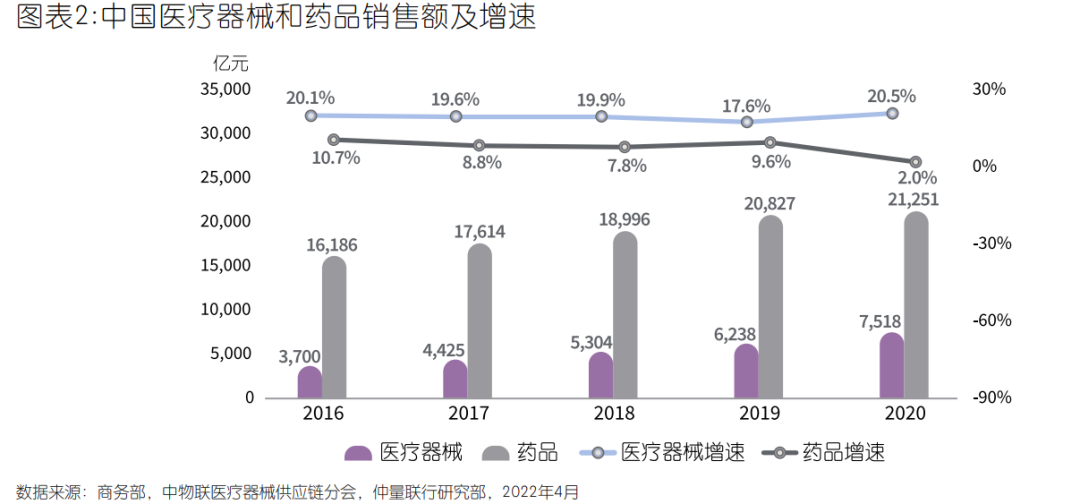
5、行业整体天花板较高,增速显著高于全球平均水平
统计数据显示,2020年中国医疗器械生产企业达26,465家,同比增辐达46%。器械销售总收入约7,518亿元,同比增长20.5%。而与此同期中国药品销售总额同比仅增长2.0%,增速下降7.6个百分点。放眼全球,中国医疗器械销售额过去五年年均增幅约20%,远高于全球5.0%的平均水平。然而从另一组数据来看,2020年中国药械比(药品/医疗器械市场规模)仅为1:0.35,而全球药械比约为1:0.72,部分发达国家甚至接近1:1。以上数据表明,我国医疗器械发展周期晚于药品行业,二三类医疗器械进口替代尚不充分,后发优势和需求潜力大,行业天花板较高。相较于发达国家的成熟市场,医疗器械临床和家庭渗透率均达到较高水平,新增需求主要来自技术更新带来的产品迭代、少数尖端领域的创新产品,以及海外市场的需求增长。中国医疗器械市场仍然处于市场快速渗透阶段,未来医保覆盖面扩大、商业医疗补充保险的不断完善、各层级医疗机构的增长、进口替代加速、医疗创新技术、家用医疗器械普及都将成为我国医疗器械行业快速发展的重要驱动力。
02
新医改对行业的影响
1、概述
过去我国药品费用占医疗总费用的比重很高,以药养医、以检养医的医疗结构为我国医疗行业发展埋下巨大隐患,医疗资源供给与患者需求长期错配:一方面患者面临看病难看病贵、过度医疗等问题;另一方面,医保基金使用效率低,长期为不合理药械价格买单。而医院则过度依赖药品、器械高利润创造经济效益,医疗服务价值难以体现。在此背景下,医保“控费”,规范医疗服务行为已成为中国医疗卫生体系可持续发展的重点议题。自2009年新医改正式启动以来,从药品到医疗器械,从三甲医院到基层医疗机构,从试点到全国复制;一系列围绕控费、降价、分级诊疗、国产创新的政策相继出台,中国的医疗改革已然进入深水区。
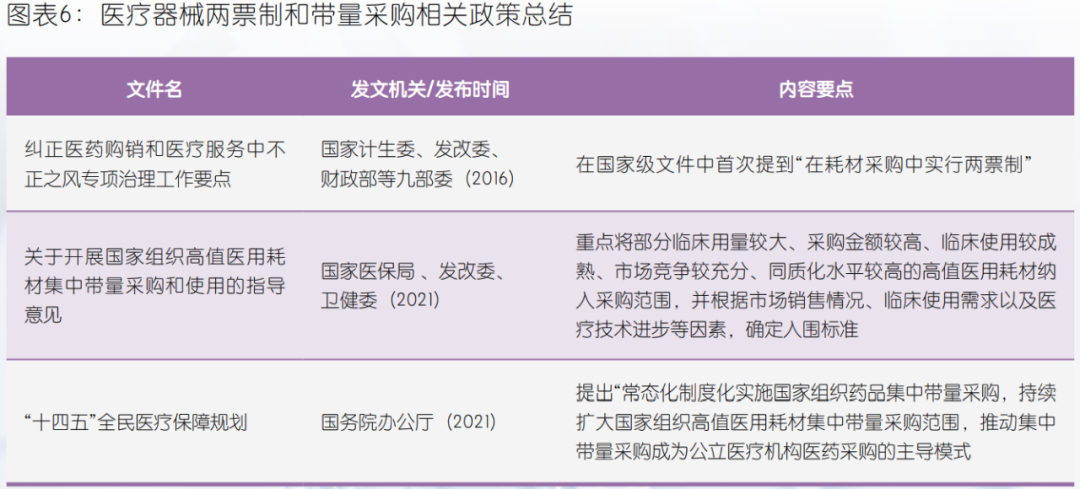
2、两票制和带量采购:压缩流通层级,以量换价
作为新医改中挤出医药流通领域水份,破除行业不正当竞争和商业贿赂的重点工程之一,2020年11月,《国家组织冠脉支架集中带量采购文件》正式发布,医疗器械高值耗材正式拉开了国家带量集中采购的序幕。首年意向采购总量占市场需求规模80%,价格平均降幅高达93%。2021年9月,第二轮高值耗材国采产品人工全髋关节、人工全膝关节紧随而至。此后国务院办公厅印发《“十四五”全民医疗保障规划》明确提出常态化、制度化实施国家组织药品集中带量采购,持续扩大国家组织高值医用耗材集中带量采购范围,推动集中带量采购成为公立医疗机构医药采购的主导模式。近期医疗器械“两票制”和带量采购政策,是继药品后医药流通领域的新一轮改革。在医疗器械带量采购上,国家医保局很大程度借鉴了药品带量采购的经验,因此药品的现行制度规范为我们预测未来医疗器械产品带量采购趋势以及流通方式提供了重要参考。
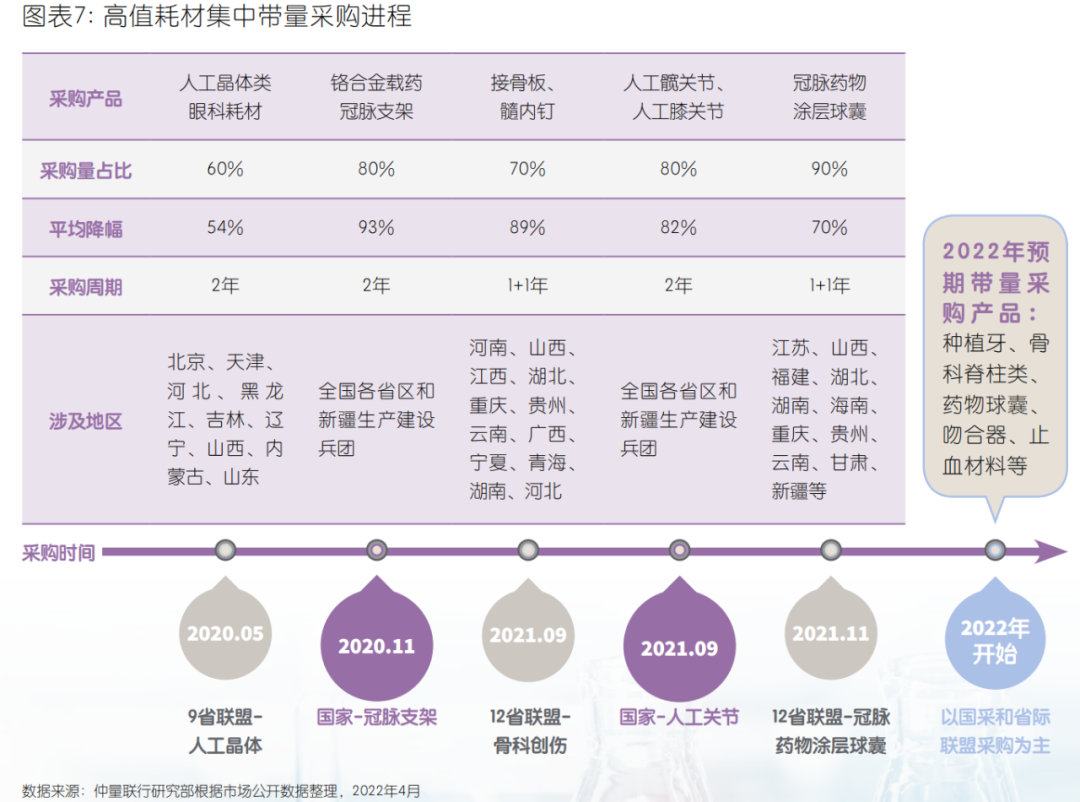
3、与药品“求同”:从“两票制”到“一票制”、带量采购
“两票制”:医疗器械行业在削减流通层级,减少经销商层层加价,推动购销行为公开透明方面有着与药品极其相似的改革路径。国务院发布《治理高值医用耗材改革方案》,鼓励各地结合实际通过“两票制”等方式减少高值医用耗材流通环节。截至2020年第一季度,全国已有超过25个省份开始全面或部分实施医用耗材两票制。带量采购向体外诊断试剂(IVD)扩展:国家及省级带量采购项目进程从高值耗材,向体外诊断试剂、医疗设备渗透。呈现品种增加,采购频次加快,采购规模扩大等趋势。2020年新冠疫情成为检测试剂带量采购的重要契机,湖北省打响了IVD集中带量采购第一枪。经此一役,IVD带量采购通路已基本打开。预计未来血球、化学发光、酶联免疫、荧光免疫等一批独立销售、与检测设备不绑定试剂将率先纳入带量采购。2021年,安徽省医药集中采购服务中心先后发布检测试剂,和大型医用设备集中带量采购的通知,安徽也是全国首个对医疗设备进行集中采购的省份。采购联盟网络格局:医疗器械带量采购与药品类似,已形成从国家到跨省联盟、省级、市级集中带量采购相互配合、协同推进的工作格局。2020年,医用耗材领域已形成十个跨省采购联盟,共涉及30个省(区、市)及新疆生产建设兵团,不同联盟间存在成员交织。以量换价:从集中带量采购的降价幅度来看,2020年共有70个项目参加集中带量采购,其中已公开发布中选结果的36个项目平均价格下降59%,最高降幅达98%,已达到了与药品相似的以量换价效果。同时集中带量采购的价格降幅也呈现从高值耗材、低值耗材到诊断试剂由高至低的趋势。
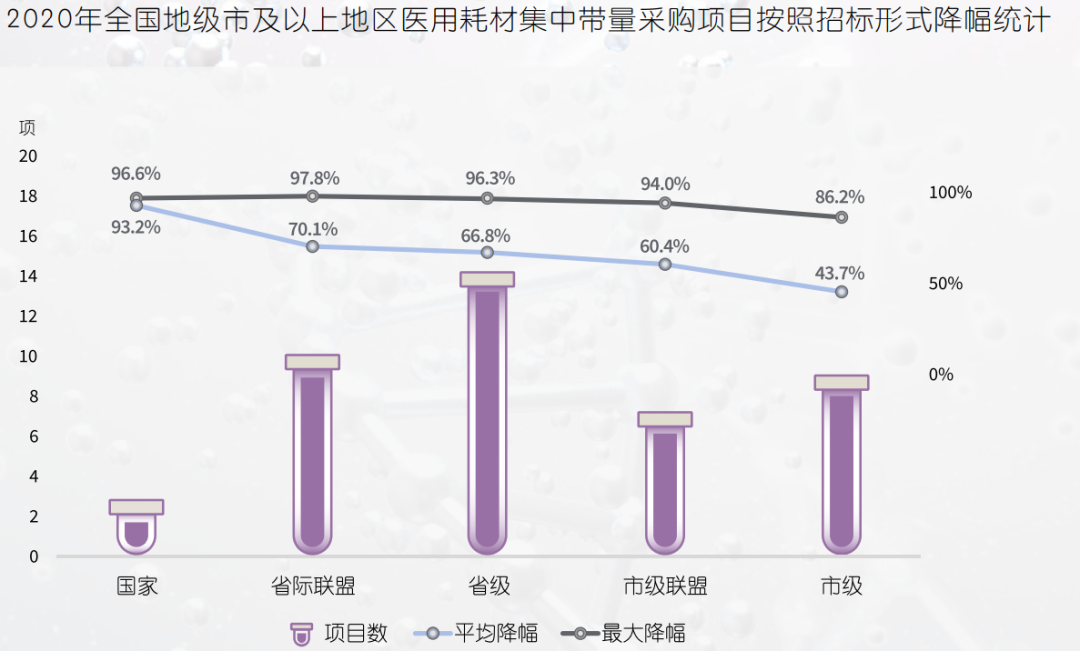
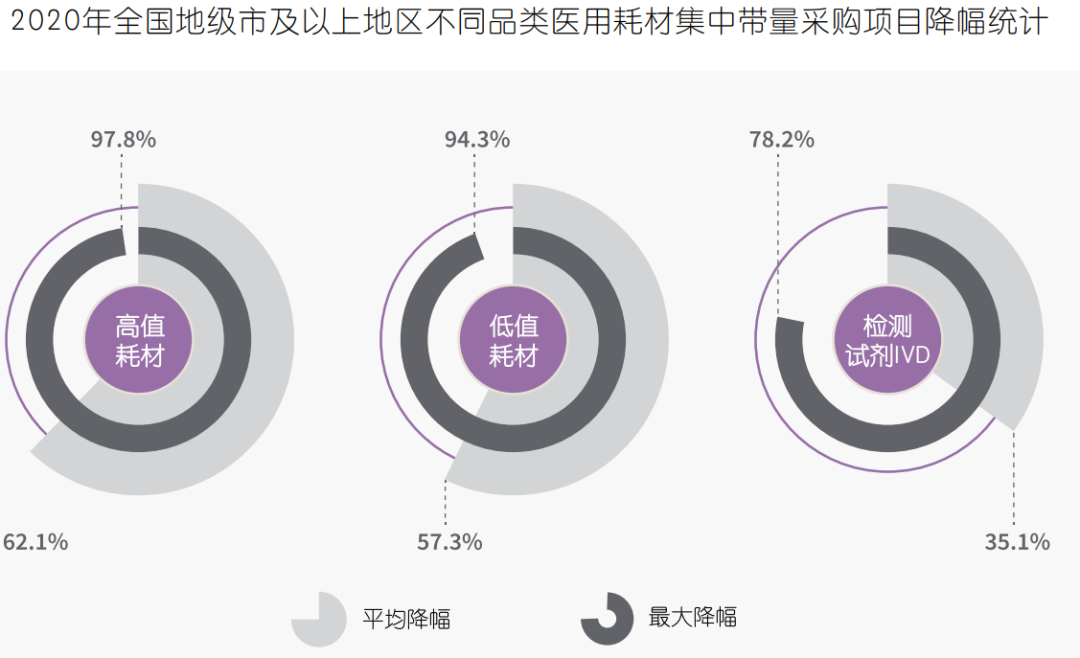
4、与药品“存异”:器械产品属性差异大,难以用同一标准横向复制
集中带量采购品种覆盖比例难以达到药品水平:2022年初,国务院常务会议提出要在2022年底前,国家和省级带量采购药品在每个省合计达到350个以上。预计未来要将占用医保基金80%的药品都纳入集中带量采购,实现应采尽采。药品带量采购之所以能够快速扩面,离不开医保对常用药品的高覆盖比例。而医疗器械医保支付比例相对较低,带量采购迫切性低于药品。同时不同于大量仿制药的药品市场,器械产品难以借鉴仿制药的“一致性评价”标准。同时在中高端医疗设备、诊断试剂领域,目前尚未达到医保占用比例高,临床用量大、国产替代率高,市场竞争充分等带量采购条件。因此大幅限制了器械带量采购品种数量,受带量采购政策影响不及药品行业。难以参照药品经验进行一致性评价:为保障带量采购药品质量,通过“一致性评价”乃是企业参与带量采购的入场券,其背后是仿制药需要在质量与药效上达到与原研药一致的水平。而这一标准却难以复制到医疗器械产品,由于医疗器械产品性质和用途差异巨大,质量标准只能通过临床数据检验,且同时包含中后期的维修、维护保养服务,不同厂家的产品有各自的一套标准体系,难以用统一标准衡量。因此目前医疗器械的“一致性评价”尚在摸索实验中。在这方面,为了更好获得临床使用数据,让产品实现全程可追溯的医疗器械唯一标识(UDI)系统正在推广。未来器械产品的质量标准评价机制将进一步完善。

https://blog.sciencenet.cn/blog-3408870-1381524.html
上一篇:
五十余位嘉宾已参与,二十场精彩报告已就绪,2023甬江智能医学论坛邀您共同参与!
