博文
Journal of proteome research丨应激条件下心肌线粒体蛋白质组生物学的改变
||
Altered Proteome Biology of Cardiac Mitochondria Under Stress Conditions
应激条件下心肌线粒体蛋白质组生物学的改变
期刊:Journal of proteome resear
影响因子:4.466
发表单位:加州大学洛杉矶分校
发表时间:2007.06
研究手段:定量蛋白质组学 免疫印迹法
研究背景:
心肌缺血再灌注损伤诱导细胞死亡。线粒体是动态的细胞器,其丰度、形态和功能在生理和病理条件下受到调节。研究表明,线粒体蛋白质组学的变化与缺血性损伤有关系。根据损伤程度,缺血可分为可逆性损伤(轻度钙超载)和不可逆性损伤(低渗损伤),目前缺乏指示这些不同类型损伤的分子靶点,因此识别不同损伤的之间的差异受到了阻碍。文章的目的是(1):定义缺血性损伤期间线粒体蛋白质组生物学。(2):对发现指示心肌缺血性损伤的新型蛋白质标记物提供参考。
研究方法:
1、体外心脏线粒体损伤模型的设计:从小鼠心肌细胞中提取线粒体,经过100 μM CaCl2处理5分钟的为可逆损伤组;经过用5mM Tris-Hcl,pH7.5,处理5min的为不可逆损伤;不经过处理的为control组。从细胞色素c氧化酶活性、细胞色素 c 的释放、线粒体肿胀的测程度、线粒体的形态以及蛋白质的翻译后修饰的氧化判断损伤模型是否建立成功。
2、用液相色谱串联质谱鉴定每组的蛋白质,并使用基因本体注释数据库 (GOA) 和 Swiss-Prot 蛋白质知识库对蛋白质的功能和位置进行注释,再利用光谱丰度因子 (SAF) 对蛋白质进行半定量分析,找出不同损伤下的线粒体释放的差异蛋白质以及候选生物标志物。
3、目标蛋白质的验证:用体外线粒体模型和免疫印迹法验证了许多关键蛋白的变化。最后,为了确定体外损伤模型是否会发生在体内,使用已建立的区域心肌损伤小鼠模型进行靶标验证。通过差速离心分离细胞质和线粒体,体内线粒体释放的蛋白质就会被捕获在细胞质部分,利用免疫印迹对细胞质蛋白质进行检测。
研究发现:
1. 不同损伤对线粒体功能的检查
与对照组相比,可逆钙治疗(RI)引起约15%的线粒体损伤。相比之下,低渗处理 ( II ) 导致超过 80% 的线粒体破裂(Fig. 1A)。不可逆损伤(Ⅱ) 与可逆性损伤 ( RI )相比,诱导更多的细胞色素 c 从线粒体中释放(Fig. 1B)。在对照组中测定了线粒体肿胀,其中 CsA 没有影响;在可逆性损伤 ( RI )组中,CsA 阻止了钙诱导的肿胀;在不可逆损伤组 ( II ) 中,CsA 不能防止钙诱导的肿胀(Fig. 1C)。(Fig. 1D)左图显示未处理的对照线粒体是具有完整膜和嵴结构的同质群体。中间面板显示了可逆损伤 ( RI )后线粒体的类似图片,几乎没有损伤/肿胀的线粒体和中度扰动的嵴结构。相比之下,不可逆损伤 ( II ) 导致大部分线粒体破裂,明显缺乏完整结构(右图)。Fig. 1E显示了不可逆损伤的更强信号,表明不可逆损伤与更高水平的 ROS 修饰蛋白的释放有关。以上说明了可逆损伤和不可逆损伤的线粒体在功能和形态上具有差异性。

Fig. 1 A:细胞色素c氧化酶活性;B:通过免疫印迹测量细胞色素 c 的释放;C:线粒体肿胀的测定;D:通过电子显微镜确定的分离线粒体的形态;E:通过免疫印迹检测作为已识别蛋白质的翻译后修饰的氧化
1. 不同损伤对线粒体释放蛋白的表征
两种损伤下的线粒体的蛋白质分为线粒体外膜(OMM)、膜间间隙(IMS)、线粒体内膜(IMM)和线粒体基质。生物学功能分析表明,可逆性损伤伴随着凋亡蛋白、转运蛋白、氧化还原相关蛋白和蛋白酶功能簇中线粒体蛋白的丢失。不可逆损伤导致参与代谢和氧化磷酸化的蛋白质发生变化(大多数蛋白质位于线粒体内膜和基质中)大量归类为基质和线粒体内膜(可能参与代谢和电子传递)的蛋白质受到不可逆损伤的影响。
此外,比较了两种损伤条件下蛋白质的差异。如Fig. 2 发现与不可逆损伤中发现的蛋白质相比,可逆损伤释放的蛋白质(与细胞凋亡/信号转导、转运和蛋白水解相关)显示出相似或更高的丰度,但是,不可逆损伤后释放的蛋白质的绝对量要大得多,这意味着这组蛋白质可能在可逆损伤中发挥着非常重要的作用。由此选取关键蛋白作为线粒体损伤的候选分子标志物。包括peroxiredoxin 5, TIM44, moesin, cytochrome c, and catalase,它们要么是可逆性损伤、不可逆性损伤所特有的,要么对两种类型的损伤都表现出分级反应,部分已经被报道在缺血性损伤中释放以及对于缺血/再灌注后的细胞存活至关重要。
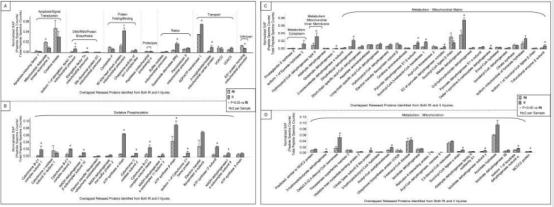
FIg. 2 使用光谱丰度因子 (SAF) 对已鉴定蛋白质进行半定量分析
2. 释放蛋白质的目标验证
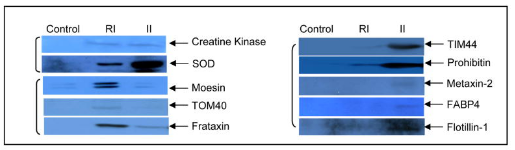
Fig. 3 已识别蛋白质的靶标验证
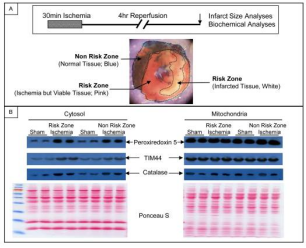
Fig. 4 在体内局部心肌缺血损伤的小鼠模型
使用分离的线粒体(体外模型),免疫印迹证明使用分离的线粒体验证了许多关键蛋白质的变化。creatine kinase和 SOD 在可逆损伤和不可逆损伤后均被释放。而 moesin、TOM40 和 frataxin 在可逆损伤中显着出现。相比之下,线粒体内膜蛋白 TIM44 和prohibitin、metaxin-2、脂肪酸结合蛋白和 flotillin-1 在不可逆损伤后释放的程度要大得多(Fig. 3)。
再用小鼠实验进行了靶标验证研究。Fig. 4表明,经历局部缺血性损伤的心脏的风险区的细胞质溶胶中过peroxiredoxin 5, TIM44, and catalase 的量增加,表明这些蛋白质在完整动物模型的严重缺血性损伤期间从线粒体中释放出来并证实了我们从分离的线粒体环境中观察到的结果。
研究结论:在细胞器破裂和死亡(不可逆损伤后)期间,线粒体蛋白质组会受到蛋白质丢失到周围环境(细胞质)中的影响;此外,在轻微的可逆损伤后,蛋白质组也发生了实质性的改变。本研究中提供的受损伤影响的线粒体蛋白蓝图是推进我们对细胞死亡机制的理解和寻找新的损伤生物标志物的重要的第一步。
文章链接:
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3805274/
参考文献:
(1) Azarashvili, T. S.; Tyynela, J.; Odinokova, I. V.; Grigorjev, P. A.; Baumann, M.; Evtodienko, Y. V.; Saris, N. E. Phosphorylation of a peptide related to subunit c of the F0F1-ATPase/ATP synthase and relationship to permeability transition pore opening in mitochondria. J. Bioenerg. Biomembr. 2002, 34, 279–284.
(2) Nagy, N.; Malik, G.; Fisher, A. B.; Das, D. K. Targeted disruption of peroxiredoxin 6 gene renders the heart vulnerable to ischemiareperfusion injury. Am. J. Physiol. 2006, 291, H2636-2640.
(3) Liu, H.; Sadygov, R.,G.; Yates, J. R., III. A model for random sampling and estimation of relative protein abundance in shortgun proteomics. Anal. Chem. 2004, 76, 4193–4201.
https://blog.sciencenet.cn/blog-3435595-1314341.html
上一篇:J proteome res(4.666)丨iTRAQ和TMT的区别
下一篇:一文读懂蛋白质间的分子对接