博文
理想气体p-V图的热力学分析
|
本文拟探讨理想气体p-V图中几个重要热力学概念。
理想气体p-V示意图参见图1.
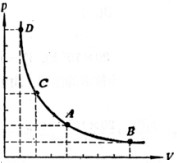
图1 理想气体的p-V示意图
1. 热力学平衡态
平衡态热力学规定系统的每一个状态,均为热力学平衡态,需同时满足热平衡、力平衡、相平衡及化学平衡,客观表现为系统每一个状态的热力学性质均固定(不随时间改变而发生变化),并且单值。
图1中点D、C、A及B均代表理想气体的一个状态,均为热力学平衡态。
2. 准静态过程
平衡态热力学规定系统由一个热力学平衡态过渡到另一个热力学平衡态,所经历的热力学过程必须是准静态过程。
准静态过程是指过程任意瞬间,系统均无限小的偏离平衡,并且随时可恢复平衡的热力学过程,客观上要求准静态过程必须无限缓慢,连续且无突变。
准静态过程δQ≡T▪dS, δWV=-p▪dV;热量与体势变的定义式与环境无关。
准静态过程通常包括自发过程、可逆过程(平衡)及非自发过程。
具体的准静态过程通常包括:恒温恒压下的化学反应及相变;恒温恒容下的化学反应及相变;理想气体的恒温、恒压、恒容或绝热过程等。
3. p-V图计算实例
[例]某双原子理想气体1mol,从始态350K,200kPa经如下两个过程达到各自的平衡态,计算过程的热量,体势变及体积功。
(1)恒温反抗50kPa恒外压不可逆膨胀;
(2)绝热反抗50kPa恒外压不可逆膨胀。
解:(1)

依题:V1=nRT/p=1×8.314×350/ 200=14.55dm3
V2=nRT/p=1×8.314×350/ 50=58.20dm3
WV ==1×8.314×350×ln(14.55/58.20)=-4.034kJ/mol
因为:恒温条件下理想气体,ΔU=Q+WV=0
所以:Q=-WV=4.034kJ/mol
另体积功:WT=-pe.ΔV=-50×(58.20-14.55)=-2.182kJ/mol
由上可知:体积功只是体势变能量再次分配的一种形式,体积功不能替代膨胀时系统功的付出。
(2)
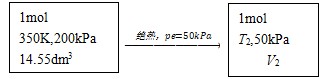
依题:绝热过程,Q=0
由热力学第一定律可得:dU=-p▪dV (1)
另对于理想气体pVT变化:dU=n▪CV,m▪dT, p=nRT/V
将上列两式分别代入式(1),变量分离并积分可得:
T▪Vγ-1=k1 (2)
p▪Vγ=k2 (3)
Tγ▪p1-γ=k3 (4)
式(2)、(3)及(4)中γ=Cp,m/Cv.m=(7/2▪R)/(5/2▪R)=1.4
将p、 V的值代入式(3)可得:
200×14.551.4=50×V21.4
解之得:V2=39.16dm3
另:T2=p2▪V2/(nR)=50×39.16/(1×8.314)=235.5K
ΔU=WV=n▪CV,m▪ΔT=1×5/2×8.314×(235.5-350)=-2.380kJ/mol
WT=-pe▪ΔV=-50×(39.16-14.55)=-1.230kJ/mol
计算结果同样显示:体积功仅为体势变的一部分。
4. 结论
(1) 平衡态热力学规定,系统每一个状态均为热力学平衡态;系统由一个状态过渡到另一个状态的过程一定是准静态过程;
(2)准静态过程δQ≡T▪dS, δWV=-p▪dV;
(3)体积功(δWT=-pe.dV)仅是体势变能量再次分配的一种形式,不能充当膨胀时系统功的付出;
(4) T▪Vγ-1=k1 ; p▪Vγ=k2 ; Tγ▪p1-γ=k3 应用前提是理想气体PVT变化的绝热过程,与过程是否可逆无关。
https://blog.sciencenet.cn/blog-3474471-1313638.html
上一篇:均相反应的G-ξ曲线讨论
下一篇:dG的物理意义(热力学公式推导)