博文
[转载]二代测序用于诊断疑似遗传病诊断
|||
二代测序用于诊断疑似遗传病诊断
Next-Generation Sequencing to Diagnose Suspected Genetic Disorders
David R. Adams, M.D., Ph.D., and Christine M. Eng, M.D.
2018.10.04 | 综述
临床下一代测序目前常用于传统上进行基因检测的医疗实践中——例如,医学遗传学以及神经遗传学等医学亚专科。新诊断应用包括作为重症监护治疗病房(特别是新生儿和儿科的重症监护治疗病房)中的快速报告方法1,以及在复杂疾病于病程早期使用2。美国、中国和其他地区的大型项目正在探索和开发临床下一代测序在精准医学中的应用3,4。这提示未来基因组数据将影响医疗决策,并且适用的患者多样且不断增长。
作为诊断工具的临床下一代测序
用于临床下一代测序的实验室技术已在许多综述中描述5;关于其在诊断试验中的应用,已发表了拟定的指南6。该技术可测得基因组大部分基因的准确可靠的序列信息。采用684名参与者的5个基因对外显子组测序和桑格(Sanger)测序(被认为是标准的测序方法)进行的比较中,外显子组测序结果的验证率为99.97%。此外,对于在高质量外显子组测序区域获得的不一致结果,外显子组测序数据正确的可能性高于第一轮桑格测序数据7。
临床下一代测序试验可以靶向一组选定的基因、外显子组(所有已知基因,或基因组的1%~2%)或者整个基因组。基因检测组合(gene panel)靶向与特定临床表型相关的几组基因。表型范围可能很窄(例如家族性高胆固醇血症检测组合中的4个基因),也可能很广(例如智力残疾检测组合中的超过1,000个基因)。临床外显子组测序靶向约22,000个蛋白质编码基因。临床基因组测序是无目标的,产生序列数据的区域是外显子组测序覆盖区域的50~100倍,包括调节区、内含子区和基因间区(图1)。

图1. 临床下一代测序(NGS)试验类型
外显子组、基因组和检测组合NGS试验具有不同的基因组覆盖特征。NGS基因检测组合试验涵盖临床诊断实验室定义的一组基因。检测组合通常将涵盖与一组相关医学病症(例如遗传性癫痫病)相关的基因。外显子组测序涵盖了大多数已知基因,包括尚未确定与人类疾病相关的基因。基因组测序涵盖了大部分基因和基因间区。每种试验类型都有一个相关的假阴性结果模式。例如,基因检测组合可能不包括突变基因,外显子组可能遗漏深内含子剪接突变。此外,基因组的某些区域难以用任何现有方法进行测序。
有关采用哪种测序方法的临床决策是一个活跃的研究领域。与外显子组测序相比,基因组测序能够对某些区域更一致地测序。新分析方法可以使用基因组测序来检测与疾病相关的、短核苷酸重复序列的结构变异和扩增。然而,用于基因组测序的生物信息学工具总体上不如外显子组测序工具发达。此外,基因组测序的费用仍高于外显子组测序的费用,部分原因是数据管理和分析的费用。
任何诊断性遗传检测的主要目标是识别可能与呈现的体征和症状确信相关的DNA序列变异体。其他检测结果可以识别在检测时不存在或未被诊断的遗传疾病的潜在风险变异体;这些结果被称为次要、偶然或医学上可采取措施的发现。有这些风险变异体的患者可能会从早期筛查和治疗受益。已有人发表了此类研究结果的临床报告指南8。
变异体分类
下一代测序产生了数千种序列变异体,必须对其进行过滤和优先级排序,以进行临床解读,因此每份报告中报告的变异体数量有限。这个过程在各个实验室之间可能略有不同,但通常包括变异体的注释、频率过滤器的应用、数据库搜索(以丰富罕见变异体并删除常见变异体)以及功能效应的预测。DNA序列变异体的临床评估包括以下两方面:对一个或多个基因功能的潜在影响,支持将目前的疾病归因于一个或多个受累基因的证据9。这两项评估均受益于强相关信息(例如变异体与疾病的相关性,无变异体与无疾病的相关性)10。然而,对于罕见的变异体或疾病,可能难以获得这样的证据。
根据进化保守性、种群频率和模拟(或测量)的对蛋白质功能的影响来评估变异体。大规模基因组测序数据库,包括基因组集合数据库(Genome Aggregation Database,gnomAD),是区分常见和罕见变异体的有效工具11。已经发表了变异体评估标准12和随后提出的修订13。这些标准包括广泛使用的评估结果分类:致病性、可能致病性、可能良性、良性和意义未知的变异体。已经为之前评估过的变异体建立了数据库(例如ClinVar),以收集和发布有关之前解读过的变异体的信息14。ClinVar使用分类评级系统来说明所提交的解读结果的证据级别。还根据与患者表型的关联,对变异体的优先次序进行排序,但必须考虑表型异质性和混合表型(在一名患者中出现多种孟德尔疾病)的可能性15。
临床实验室主要报告基因-疾病关联已经确立的基因变异体。在其他情况下,提议的关联将是新的,这样产生“N=1”情况(在这种情况中,诊断不能被认为是明确的),以及建立新的基因-疾病关联的机会10。频率数据库的改进使得之前已确立的致病性变异体重新分类,通过这一方法定期说明对将疾病与基因和变异体错误关联的风险16。查找其他病例的一种创新方法是使用匹配数据库。Gene-Matcher(https://genematcher.org/)、DECIPHER(https://decipher.sanger.ac.uk/)和Phenome-Central(https://www.phenomecentral.org/)可利用去除身份标记的数据(例如基因名称或疾病特征)识别匹配的病例17-19。基因组匹配与交换(Matchmaker Exchange)计划可在这样的数据库之间进行匹配20。这些工具是公开的,且不需要计算机专业知识。
诊断率和检测策略
因检测组合
基因检测组合(通过下一代测序方法测序的选定基因)的诊断率通常比外显子组测序或基因组测序高,设计用于增加对所包含基因的覆盖范围、敏感度和特异度。在诊断的不确定性较大的背景下可能出现例外情况,对于例外情况,模拟数据提示外显子组测序可能具有较高的诊断率21。例如,在一项包括50例周围神经病变患者的研究中,一个虚拟检测组合来自外显子组测序数据的一个子集。利用这一检测组合,成功确定了50个诊断中的11个。随后使用全套外显子组数据进行的分析产生了另外8个诊断22。
检测组合通常用于特定的疑似疾病或一组疾病。不同的基因检测组合的诊断率不同。例如,设计用于遗传性视网膜疾病的222基因检测组合对192例遗传性视网膜疾病患者中的98例(51%)做出了诊断23。对于早发性癫痫(一种更具遗传异质性的表型),使用与该表型相关的172个基因组成靶向检测组合时,诊断率约为30% 24。在检测组合包括的172个基因中,共有156个显示无异常,这突出了诊断率可能不会随着所包含基因数量增加而呈线性增加25。
下一代测序基因检测组合的费用存在差异,但通常低于外显子组测序的费用。较昂贵的检测组合可能包括其他测序技术,以提高核苷酸重复突变检测的可靠性,或添加检测缺失和重复的方法。
临床基因组和外显子组测序
临床基因组和外显子组测序通常用于之前检测组合测定结果为阴性的患者,或者鉴别诊断范围广泛的复杂表型患者。这些方法具有评估所有已知疾病基因的优点,同时当进行变异体分类和检测新基因时,可提供用于将来再分析的底物。当临床基因组和外显子组测序用于有疑似遗传性疾病,但未经诊断的患者时,有25%~52%比例的检测能够提供分子诊断,并且该分子诊断很可能能够解释疾病26-29。根据适应证,该诊断率可能超过其他广泛使用的基因诊断工具,例如染色体微阵列分析30。
据报告,在一个例子中,当患者(先证者)的测序与亲生父母的测序同时进行时(三重检测),诊断率提高了16个百分点31。该方法强调了将所有被检人员的临床表型通知检测实验室的重要性。借助准确的信息,可以证实未患病的父母没有先证者的新(从头)突变,并且对于隐性疾病,可以证实预期分离模式;这类信息能够增强对诊断的信心。
实际诊断率高度依赖于被检人群、是否有其他家庭成员信息以及高可能性诊断的定义;据报告,在选定的疾病队列中,实际诊断率高达60% 32。诊断敏感度可能随患病的器官系统而异26。其余无法解释的病例提示,新的遗传病有待发现和鉴定。这些疾病的潜在生物学机制可能包括新的孟德尔疾病、基因相互作用、上位性、表观遗传机制、未捕获的遗传变异(如拷贝数变异)和环境影响。关于在特定环境中使用的适当检测策略,最终临床决策需要结合以下几方面信息:诊断不确定性、检测组合设计、费用和可预测的致病突变的性质(表1)。
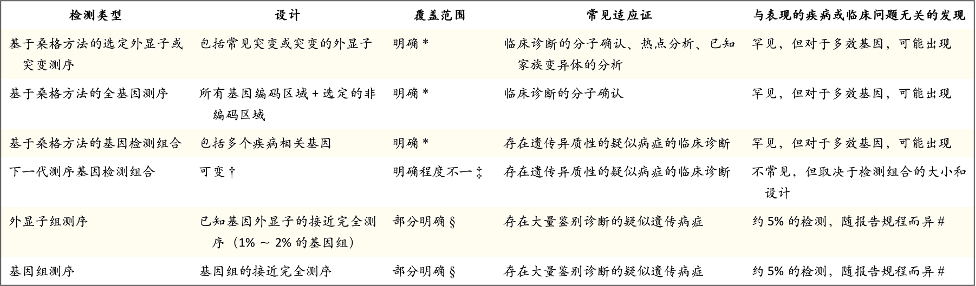
表1. 基于序列的检测形式
* 假阴性罕见,检测结果文档包含对所涵盖内容的清晰描述。
† 有两种主要方法。在第一种方法中,使用类似外显子组的捕获技术,但只捕获了一部分基因。在第二种方法中,收集完整的外显子组数据,但仅将一部分基因返回给分析员。
‡ 实验室可能会指出测序技术可能遗漏某些区域。在许多情况下,将通过桑格测序评估未通过下一代测序方法进行良好测序的区域,以避免假阴性结果。
§ 少数编码区域不会通过下一代测序方法进行测序。实验室未精确定义这些遗漏区域。
# 不同的规程包括对美国医学遗传学和基因组学会(American College of Medical Genetics and Genomics)指南的遵循程度、携带者状态结果的返回以及其他因素。在患者签署知情同意书的过程中,患者可以在这方面做出选择。
临床下一代测序的实施
经常使用临床下一代测序的临床医师已经建立了基础流程,用于获得患者同意,并在检测之前和之后为患者及其家人提供咨询。检测从样本采集(通常为血液样本,唾液、口腔拭子或血斑可能也可以,取决于所使用的实验室)开始,并通过复杂的实验室和分析工作流程进行(图2)。最终报告包括与所表现疾病已知相关的基因中的DNA序列变异体,以及潜在致病变异体(包括意义不确定的变异体)的评估。还可能包括与所表现疾病无关的基因变异体,例如在当前未发现与特定疾病相关的新基因中,预测的致病性变异体。
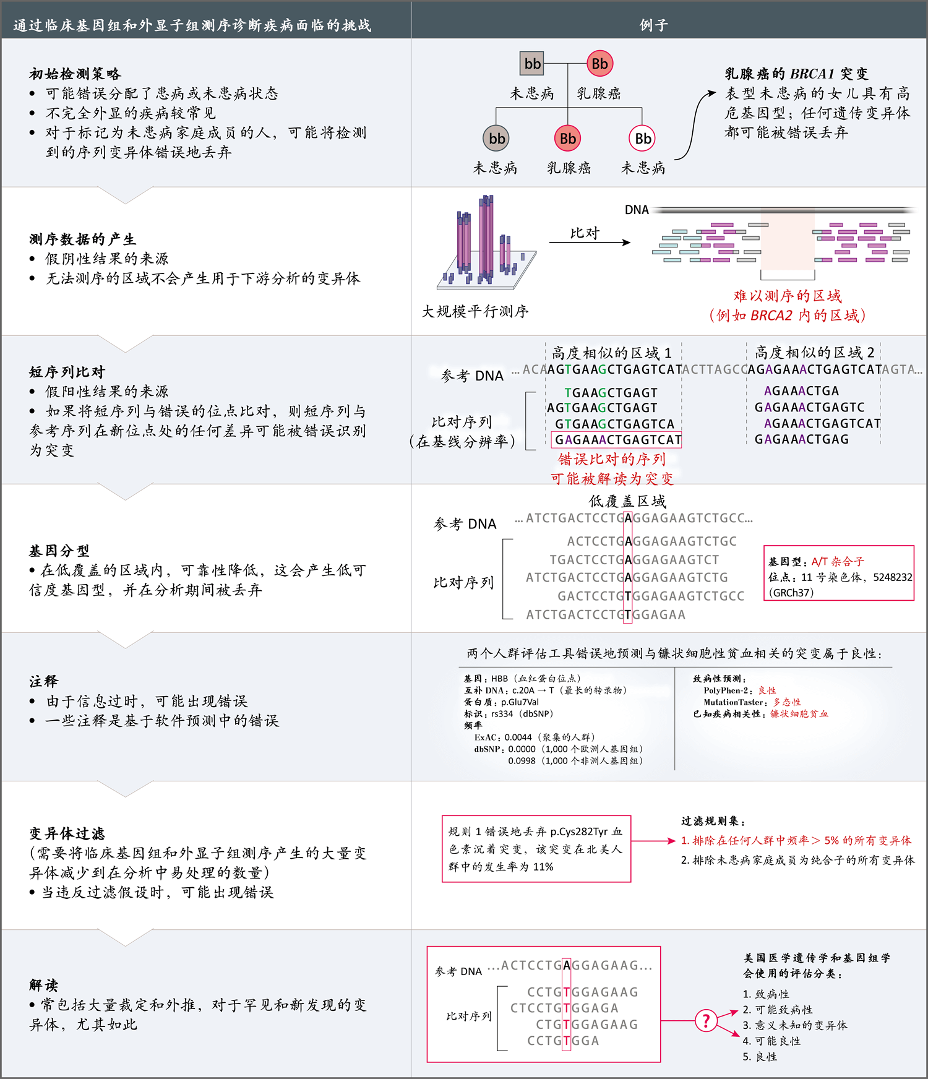
图2. 临床NGS的实验室和分析工作流程
术语dbSNP表示单核苷酸多态性数据库(Database of Single-Nucleotide Polymorphisms),ExAC表示外显子组集合数据库(Exome Aggregation Consortium),PolyPhen-2表示多态性表型分型,版本2。
报告规程可能存在差异,这些报告规程可能是特定检测或诊断实验室特有的;因此,仔细评估检测特征和局限性对于下检测医嘱的医师来说很重要。模拟示例报告见补充附录,补充附录与本文全文可在NEJM.org获取。在大多数商业检测实验室,个体患者均可通过一些途径申请发布他们的原始检测数据,以便进行再分析、获取他人意见或用于研究。
遗传检测结果可以为临床诊断提供支持,改变未来的疾病风险,并为各种疗法的个体化定制提供信息。正在进行的研究将下一代测序获得的结果纳入医疗机构的临床实践,这可能有助于阐明未来广泛使用此类测序面临的挑战,包括患者拒绝接受某些类型结果的权利33。知情同意是临床下一代测序检测的重要组成部分。适当的知情同意过程收集患者希望收到的次要结果的信息(如果有的话),并就发现意外风险变异体的可能性提供咨询。美国医学遗传学和基因组学会(ACMGG)发表了一份基因列表,这些基因具有临床上重要的健康关联,并有可能改变治疗决策8。目前大多数实验室都将此作为最低限度的次要结果提供。在对其他结果(例如隐性疾病的携带者状态、改变风险的变异体和药物基因组学变异体)的考虑和返回方面,标准化程度较低。
知情同意过程还应阐明基因检测的潜在风险,例如隐私和歧视问题。2008年《遗传信息法》(Genetic Information Act)禁止就业和健康保险中的遗传歧视,但在获取人身、伤残或长期护理保险方面,禁止遗传歧视的条款并未包括34。
保险赔付
公共和私营承保机构对临床下一代测序(和结果分析)费用的覆盖均落后于将下一代测序带到临床应用的技术进步35。承保机构在做出承保决定时通常会考虑几个因素,包括检测方法的分析效度和临床效度、专业学会指南和循证科学文献。承保决定通常基于在临床上使用该检测方法属于实验性、研究性还是医学上必要。
对通过下一代测序基因检测组合、外显子组测序和基因组测序进行的诊断检测实施赔付时,可能随保险商和具体保险计划不同而有所不同。通常需要承保机构进行预授权。下检测医嘱的医师必须提供证明检测合理性的临床说明,包括详细说明检测结果如何影响治疗。拒赔后的申诉,以及与承保机构医疗主管进行同行讨论这两种情况预期可能出现。拒赔后的申诉可能包括诊断率以及可从临床诊断实验室获得的其他数据。一些检测实验室提供的自付选项和财务协助计划有助于在保险商拒绝承保时获得检测服务。此外,近年来基因组测序的费用总体下降。最终,需要对临床应用价值和成本效益进行研究,以改善患者和家人的检测承保覆盖和获取途径。
临床应用价值研究
及时诊断可以改变治疗、为计划生育提供有关复发风险的准确信息,并可以通过结束长期艰难的诊断过程而节省医疗费用。一项研究纳入了临床遗传学家选择的44名儿童,研究中通过仅先证者的外显子组测序,对23名(52%)儿童做出了诊断。其中25%的临床治疗发生了改变。发病至诊断的平均时间为6年,如果能够更早进行外显子组测序,将能够节省这段时间的诊治费用27。
在另外一项研究中,对63名重症婴儿进行了外显子组测序,患儿平均年龄为33.1日,诊断率为51%,诊断结果影响了其中72%患儿的治疗1。在同一项研究中,81名死亡婴儿中有39名通过外显子组测序得到诊断。
一项研究将42名患者的基因组测序与一组标准遗传检测进行比较,结果显示诊断率分别为43%和10% 36。在31%的病例中显示出临床应用价值,对于包括6名患者的一个患者组,因治疗改变节省的总费用估计为100万~200万美元。据报告,对于外显子组测序无法诊断的患者,进行基因组测序显示出一些额外的价值37。
挑战和机遇
临床下一代测序技术发展迅速,其步伐经常超过用于制定标准和指南的现有资源。例子包括在电子病历(EMR)中存储基因组数据、数据再分析以及创建全球人群基因组变异的数据库。
EMR中的基因组数据存储规范存在差异。正在研究EMR集成模型,目的是将其用于进行中的患者治疗,模型例如电子病历和基因组学(Electronic Medical Records and Genomics,eMERGE)及临床实践中的基因组学应用(Implementing Genomics in Practice,IGNITE)网络38。
通常利用当时的最佳证据来撰写临床测序报告。随着新信息的产生,对检测数据的再分析可能导致对先前临床意义不明确的DNA变异体进行重新分类。在最近的一项研究中,在初步解读结果后12个月对外显子组进行了再分析,产生了另外的诊断,并且发现这是一种符合成本效益的诊断方法39。对于下医嘱的医师,再分析可能会随着时间的推移继续产生新的结果,但有其自身的风险和益处,包括与新结果所属的患者失去联系。
健康人
基因组数据是精准医学的潜在组成部分,外显子组和基因组序列已被描述为终身临床资源40,41。除上述用途外,这些数据还可能改善对常见疾病的风险估计、药物基因组学数据和迟发性疾病的诊断。外显子组测序检查平均检测1~7种携带者变异体,一项试验42显示,2%的检查在ACMGG建议的至少1种基因产生了的可能能够采取措施的致病性或可能致病性变异体,用于强制性次要结果报告8。目前的药物标签中包括约130种药物基因组生物标志物43,但关于各种变异体的药物基因组学数据的应用价值,文献观点不一。大多数人有一个或多个这样的变异体,eMERGE网络研究显示5,000人队列中每个人的这样的变异体中位数为2 44。然而,基因型指导下的华法林给药研究(可以说是最有名的药物基因组学研究之一)尚未得出明确的指引性结论45。
虽然人们倾向于尽快投入应用,但需要运用高质量的科学方法来评估健康人群中常见疾病的风险和基因组数据的其他用途46。在一项包括健康人的基因组序列分析研究中,在22%的人中检测出了单基因疾病风险,但检测结果的临床应用价值不确定47。我们需要在目前和未来的研究中确定不同人群的基因组变异。被检者的祖先或族群与现有人群(“对照”)数据之间的不匹配会对检测性能产生负面影响。
未来发展方向
临床基因组和外显子组测序领域正在迅速发展,许多项目集中于提高诊断率。目前受关注的领域包括RNA检测的整合48、结构变异体的检测49,50以及与检测方法(基因检测组合、外显子组和基因组检测)相关的决策的改进51。正在进行和计划中的基因组学和健康研究正在增进我们对基因组变异与疾病之间关系的了解52,53。将临床下一代测序纳入常规医疗的未来临床计划可能预示着现有人类基因组和外显子组序列总数的大幅增加。费用、伦理学和标准方面的进展将有助于建立一条路线,通过这一路线将临床下一代测序和相关技术更广泛地纳入常规医疗实践中。考虑到过去5年的发展速度之快,所有医务人员都应该密切关注这一变革性领域发生的变化。
参考文献(略)
https://blog.sciencenet.cn/blog-682704-1368999.html
上一篇:[转载]新生儿基因筛查与遗传咨询项目实施方案--中国出生缺陷干预救助基金会