博文
与新冠病毒感染相关的宿主因子的鉴定
||
与新冠病毒感染相关的宿主因子的鉴定
本文为读后感,原文见文后,读后感作者:陈埔
为了更好地了解宿主病毒的遗传依赖性并找到COVID-19的潜在治疗靶标,研究者进行了基因组规模的CRISPR功能丧失筛选,以鉴定人肺泡上皮细胞SARS-CoV-2病毒感染所需的宿主因子。排名靠前的基因聚集到不同的途径中,包括液泡ATPase质子泵,Retromer和Commander复合物。我们使用几种正交方法验证这些基因靶标,例如CRISPR敲除,RNA干扰敲除和小分子抑制剂。使用单细胞RNA测序,我们确定了失去排名靠前的基因后胆固醇生物合成中共有的转录水平的变化。此外,鉴于ACE2受体在病毒进入的早期阶段起着关键作用,研究者发现RAB7A的缺失导致细胞内的ACE2受体聚集而不能运送到细胞外,从而降低了病毒进入。总的来说,这项工作为每个宿主基因的丧失对病毒感染的适应性/反应的影响提供了一个基因组规模的定量资源。
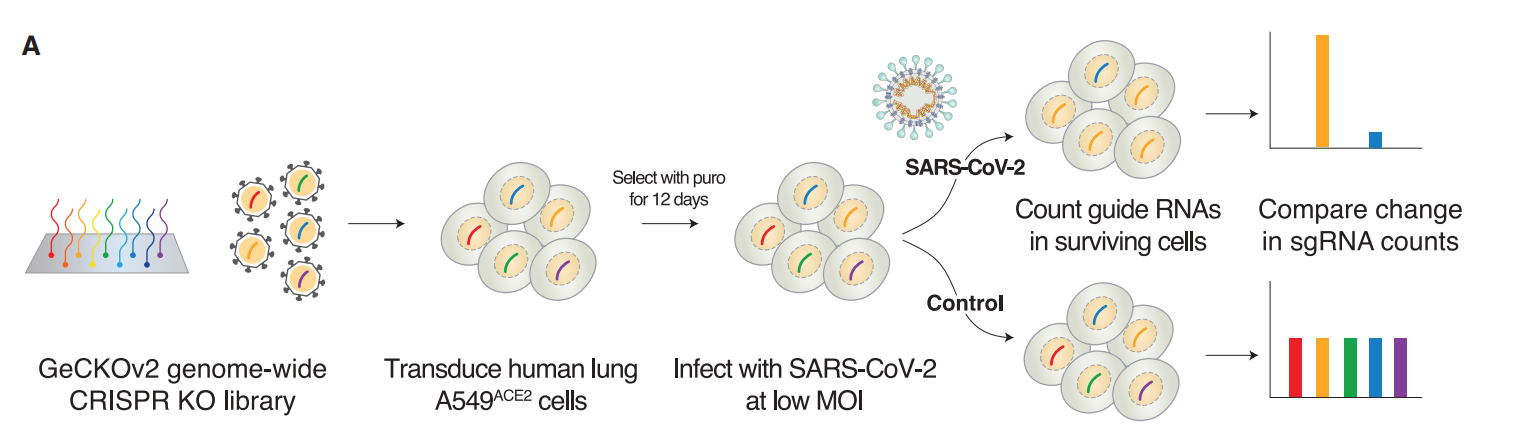
文章所采用的基本的实验流程如上图所示,通过crispr-cas9技术对功能基因进行敲除,然后感染病毒,最后对比sgRNA的丰度,从而确定与病毒感染相关
的基因。
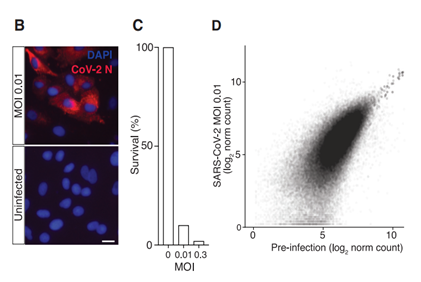
通过基因敲除一些功能基因之后,细胞感染病毒后的存活率进一步提高。
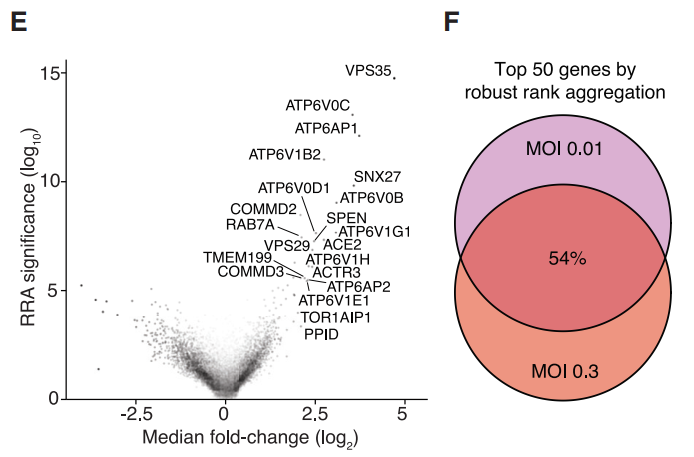
比较不同基因在感染病毒之后的表达差异,可以判断出,有哪些基因参与到了病毒的感染过程,这些基因在不同的感染剂量的条件下,发挥的作用可能有所不同,不同剂量的病毒感染后,有一部分基因是重叠的。
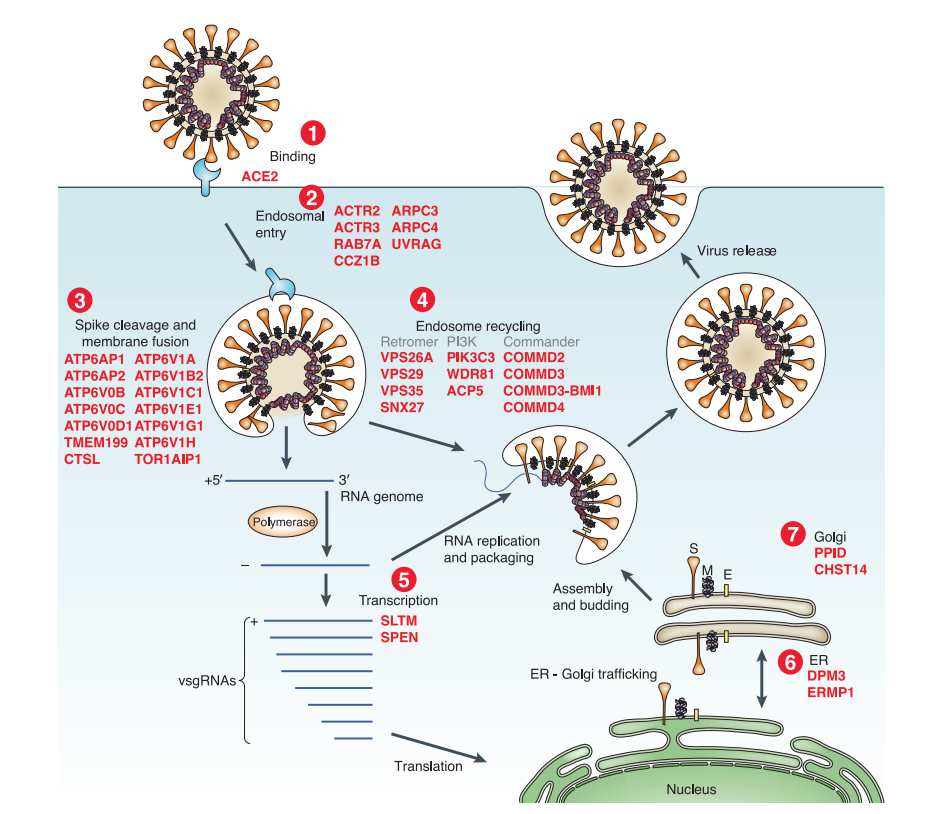
将寻找到的不同的基因进行分类,多种多样的宿主因子参与到了病毒的各个生命周期过程。
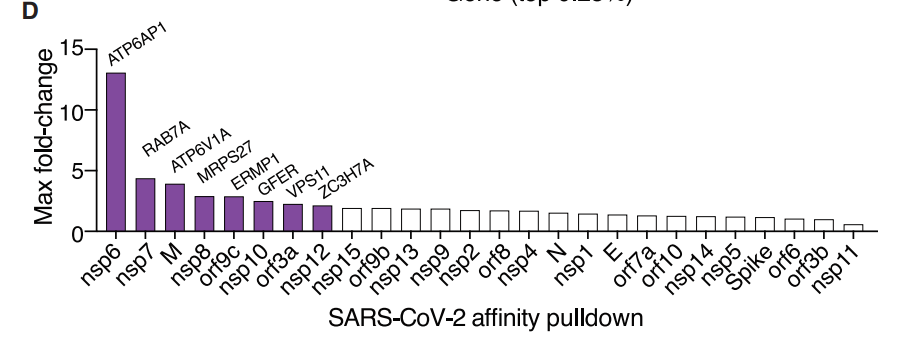
结合以往的文章,与本文结合,可以发现,本文的研究中发现的部分蛋白具有与病毒蛋白相互作用的能力。
为了寻找病毒感染过程中,有哪些细胞通路参与了病毒的生命周期,作者将文章中所发现的基因进行分类,可以发现,排名靠前的有ATPase,内体相关蛋白等。

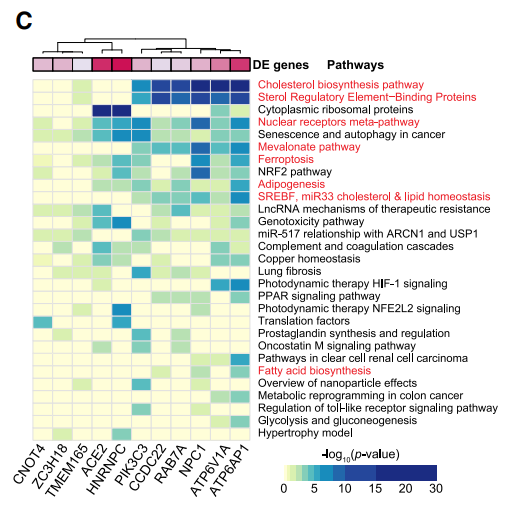
那么,这些细胞通路或者蛋白复合体是如何参与到病毒的生命周期中的,作者进行了单细胞测序,对病毒感染敏感的细胞通路进行归类,可以发现,磷脂和胆固醇的稳定合成对病毒的感染具有显著的影响。
为了验证磷脂和胆固醇的变化是如何影响病毒的感染的,作者通过敲除对磷脂和胆固醇的合成影响最大的一个基因RAB7A,敲除该基因,可以看到病毒的受体ACE2向外膜的转运减少,从而抑制了病毒的感染。
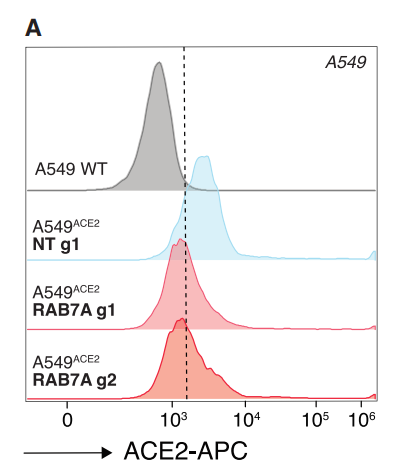
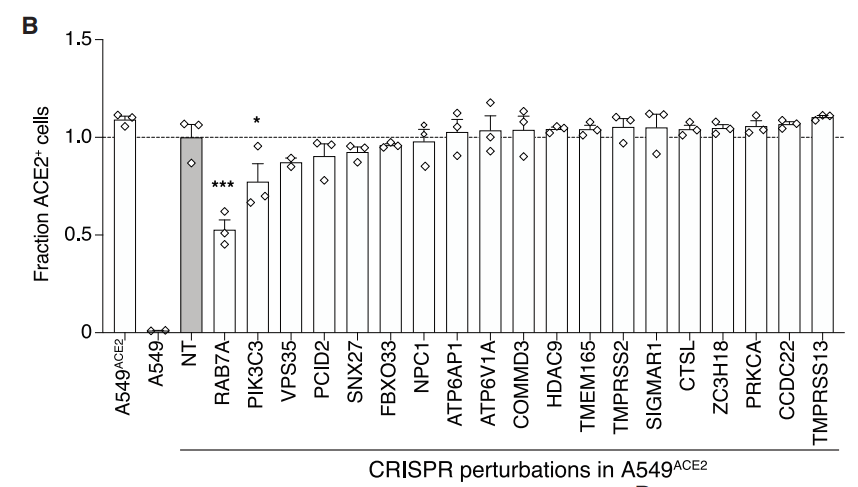

这项研究确定了SARS-CoV-2病毒发病机理中的重要宿主基因,并通过广泛的分析和实验方法验证了它们在感染中的核心作用,此外,还确定了潜在基因的潜在机制,包括胆固醇合成和内体功能,除了指导新的治疗目标以帮助结束新冠的流行之外,研究还提供了一个框架,可以利用大规模并行的基因组编辑来了解疾病的遗传学和感染机制。
原文:https://pubmed.ncbi.nlm.nih.gov/33147445/
Daniloski Z, Jordan TX, Wessels HH, Hoagland DA, Kasela S, Legut M, Maniatis S, Mimitou EP, Lu L, Geller E, Danziger O, Rosenberg BR, Phatnani H, Smibert P, Lappalainen T, tenOever BR, Sanjana NE. Identification of Required Host Factors for SARS-CoV-2 Infection in Human Cells. Cell. 2021 Jan 7;184(1):92-105.e16.
doi: 10.1016/j.cell.2020.10.030. Epub 2020 Oct 24. PMID: 33147445; PMCID: PMC7584921.
https://blog.sciencenet.cn/blog-2484430-1282291.html
上一篇:冠状病毒复制体的分子孔道结构
下一篇:靶向SARS-CoV-2刺突蛋白的感染性增强抗体的位点