博文
新冠病毒RNA聚合酶催化亚基存在铁硫簇,并可作为潜在的药物靶点
||
新冠病毒RNA聚合酶催化亚基存在铁硫簇,并可作为潜在的药物靶点
本文为读后感,原文见文后,读后感作者:李子恒
新冠病毒的RNA依赖RNA聚合酶(RdRp)是病毒复制的核心组件,包括nsp12、nsp7和nsp8等。之前的研究已经采用冷冻电镜技术解析了新冠病毒RdRp的三维结构。冷冻电镜结果表明Nsp12包含两个较大的结构域,一个是RdRp保守结构域,另外一个是套式病毒(nidovirus)特有的NiRAN结构域,两个结构域通过interface结构域相连接。

值得一提的是,在nsp12结构中锌指结构存在于两个位置,分别位于interface区域及RDRP区的finger区。并且这一段锌指结构在已知的冠状病毒在nsp12的锌指结构的基因序列高度保守,在s-1和s-2的结构中都有得到证实。
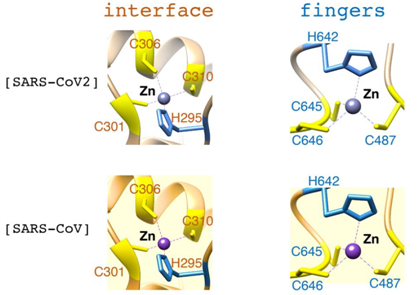
铁硫簇是一类普遍存在于生物体中的最古老的生命物质之一,起着包括参与电子传递、底物的结合与激活、铁/硫的存储、基因表达的调控、酶活的调控等作用。由于铁硫簇在氧化条件下很不稳定,很容易发生降解,蛋白纯化过程往往会导致锌离子取代内源的铁硫簇。因而在结构解析中发现zn指结构。由于在nsp12的结构中已经发现了zn指结构,这也就引出了本文的两个问题,这些内源的铁硫簇是否存在于新冠病毒RNA聚合酶中?这些铁硫簇在RdRp的功能行使方面,起着怎样的作用呢?
首先,作者利用先前开发的技术对新冠病毒蛋白铁硫簇辅因子进行了鉴定,结果发现各株新冠病毒的nsp12均存在保守的亮氨酸-精氨酸-酪氨酸基序,而这段基序是伴侣蛋白伴侣蛋白HSC20的结合位点。该蛋白参与铁硫簇生物合成与转移,具体的转运模型如图所示。
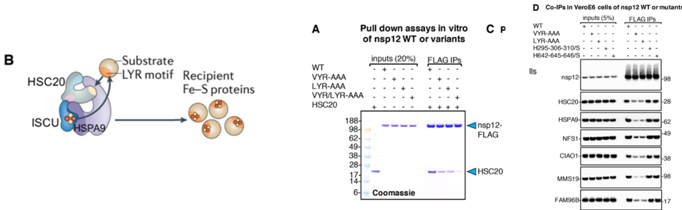
即HSC20通过LYR这一特定的序列与蛋白结合,直接结合在主支架蛋白ISCU,hsc20同源伴侣HSPA9水解ATP提供能量,从而完成铁硫簇生物合成与转移。通过pull-down和免疫共沉淀试验,研究者发现野生型nsp12能够与HSC20结合,而将基序突变为丙氨酸后则不能结合。而后作者将细胞内与铁硫簇形成的相关信号因子,通过co-ip的方法进行了验证,结果均能得到相关条带。
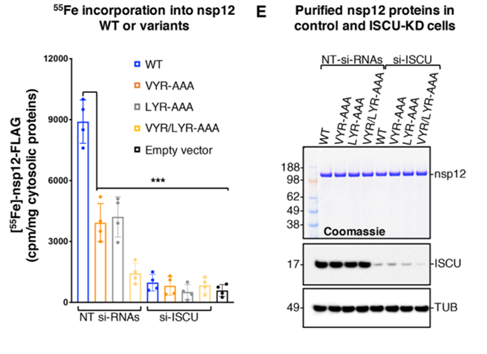
为了进一步验证nsp12中是否含有铁硫簇,作者通过利用铁的同位素标记法标记了细胞中的铁元素,结果发现,WT与LYR的突变体相比,WT的结合能力明显强于突变体,通过RNA感染技术将之前提到的铁硫蛋白生成和转运过程中的主支架蛋白ISCU蛋白沉默,nsp12完全丧失了结合铁的能力以上证明了nsp12。
以上证明了nsp12结合铁离子,并且很有可能是以铁硫簇的方式结合铁的。那么在nsp12中铁硫簇的位置是否和作者所推测的,即nsp12的锌指结构处,一致呢?

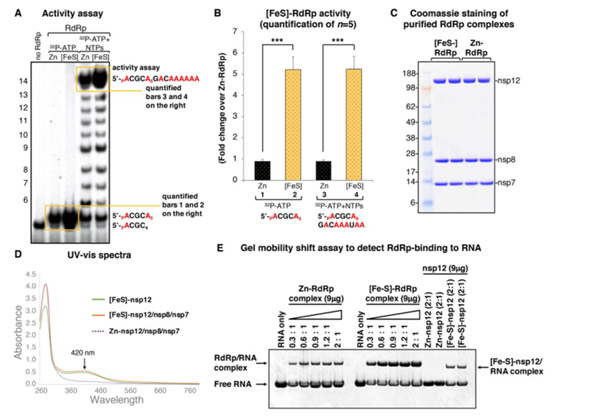
通过紫外光谱分析可以看到,在nsp12经螯合剂EDTA处理后的光谱显示在420nm处完全丧失吸光度,当NSP12的锌指结构中半胱氨酸被丝氨酸取代吸光度也出现了相同的现象。但是分别突变这两个位点的nsp12有在420nm处的存在吸光度的下降,但未完全丧失。在同位素实验出现了两个锌指位置分别的突变,较野生型的nsp12结合铁离子的能力有明显下降,两个位置全部突变后,nsp12的铁离子结合能力几乎完全丧失,推测由可能出现一个或多个铁硫簇。为了进一步确认铁硫簇的种类,作者使用了穆斯堡尔光谱法进行分析,穆斯堡尔光谱法主要原理固体中的某些放射性原子核有一定的几率能够无反冲地发射γ射线,γ光子携带了全部的核跃迁能量。而处于基态的固体中的同种核对前者发射的γ射线也有一定的几率能够无反冲地共振吸收,通过测定这些共振光谱,达到测定物质中的具体成分的目的。通过测定,作者发现野生型nsp12结合7.5±0.35个铁原子每个单体,而两个突变体的结合3.5个铁原子。因此证实了nsp12中含有两个铁硫簇,铁硫簇的形式为为[Fe4-S4]2+。
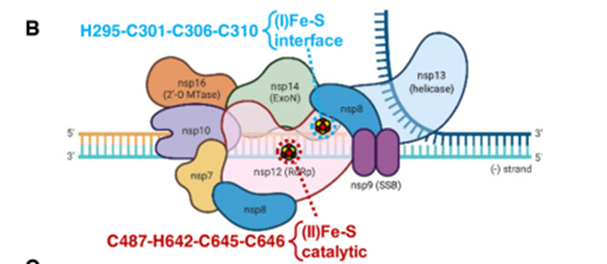
接下来作者验证两个Fe-S的簇在RdRp的作用。如上图所示,nsp12催化域的[Fe4S4]簇是在nsp12-nsp7-nsp8复合物发挥的RNA聚合酶活性的过程中起关键性的作用。nsp12在C487S-C645S-C646S变异的催化结构域引起了RdRp酶活的下降更为显著。而缺失interface另一个则影响与nsp13解旋酶的结合。
作者比较了铁硫蛋白和锌指蛋白在RNA结合能力及聚合酶活性的差异,结果表明拥有铁硫簇的RdRp复合物的RNA结合和聚合酶活性与锌RdRp相比显著增加与。结果如图所示,可以发现铁硫簇蛋白的RNA聚合酶活性明显强于锌指蛋白。并且在E图中可以看到,Fe-S-nsp12可在缺少nsp7和nsp8的情况下与RNA样品结合,而锌指蛋白则不能。通过结构分析,作者提到通过结构对比表明锌,通过与铁硫簇相同的半胱氨酸残基,可以部分完成Fe-S簇的结构作用,保持手指亚结构域的结构不变,并保持一些聚合酶活性。
由于铁硫簇易受氧化剂的破坏,研究者尝试利用一种稳定的有机含氮氧化物TEMPOL,特异性氧化并解离铁硫簇。TEMPOL体外处理的RdRp失去了铁硫簇,导致聚合酶活性下降,而与此同时线粒体含铁硫簇的酶复合体、胞质铁硫簇酶都未受到影响。一氧化氮供体DEA/NO也能发挥类似作用。研究者在细胞模型上测试了TEMPOL,发现该化合物既能够抑制RdRP。0.4mM浓度TEMPOL可以使病毒滴度下降明显。并且TEMPOL与常见的RdRp抑制剂瑞德西韦(RDV)相比,更为有效,且TEMPOL能与RDV起协同作用。

原文链接:
Maio N, Lafont BAP, Sil D, Li Y, Bollinger JM Jr, Krebs C, Pierson TC, Linehan WM, Rouault TA. Fe-S cofactors in the SARS-CoV-2 RNA-dependent RNA polymerase are potential antiviral targets. Science. 2021 Jun 3:eabi5224.
doi: 10.1126/science.abi5224. Epub ahead of print. PMID: 34083449.
https://blog.sciencenet.cn/blog-2484430-1294467.html
上一篇:比较蛋白组学揭示SLFN5是一种抑制疱疹病毒转录的限制因子
下一篇:通过提高MAVS活性拮抗SARS-CoV-2衣壳蛋白的液液相分离以提升抗病毒天然免疫